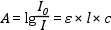Molekulaspektroszkópia. A molekulaspektroszkópia az ismert energiájú elektromágneses sugárzásnak a molekulákon létrehozott hatásával foglalkozó tudomány. A gyakorlati alkalmazásban a molekulák jól definiált energiaszintjei közötti átmenetek vizsgálhatók a besugárzott energia egy részének elnyelésén (abszorpció) vagy energia-kibocsátáson (emisszó) keresztül.
Spektrokémiai alapismeretek áttekintése. Molekulaspektroszkópiai vizsgálatok kvantitatív meghatározásokhoz
Egy molekula vagy atom alapállapotának a legalacsonyabb energiájú állapotát nevezzük. Egy molekula (vagy atom) gerjesztett állapotba kerül, vagyis energiája nő, amikor megfelelő energiájú elektromágneses sugárzást (pl. fotont) nyel el (abszorbeál). Ezzel analóg módon, foton kibocsátása (emittálás) közben a molekula energiája csökken. Az energiaátadás következtében, ha a sugárzás hatására az anyag energiája nő, ez együtt jár a besugárzásra használt fény intenzitásának csökkenésével. Ez az energiaváltozás egyrészt az anyagi minőségtől, másrészt a fényt elnyelő részecskék mennyiségétől függ, és így mind minőségi mind mennyiségi analitikai információt szolgáltat.
A spektrofotometria módszerének előnye nagy érzékenysége, nagy pontossága, egyszerűsége, gyorsasága, kis mintaigénye. Hátrány viszont, hogy hozzávetőlegesen tudnunk kell, melyek a meghatározandó komponensek
A természetben ismert fehér fény különböző energiájú sugárzás keveréke. Az analitikai kémiai vizsgálatokhoz ezt a fényt komponenseire kell bontanunk. Az elektromágneses sugárzás hullámhossz szerinti felbontása monokromatikus fényhez vezet, amely egy nagyon szűk hullámhossz tartományú fotonokat tartalmazó fénynyaláb. Ez szolgál mind a kvalitatív, mind a kvantitatív vizsgálatok céljára.
Adott hullámhosszú és ismert intenzitású fénnyel egy mintát besugározva a fény részben a mintában elnyelődik (abszorpció), másik része áthalad rajta (transzmisszió), harmadrészt visszaverődik (reflexió). Az intenzitásokra tehát igaz az alábbi egyenlőség:
I0 = IT + IA + IR
ahol I0 a besugárzó fény intenzitása, IT a transzmittált (a minta által átengedett), IA az abszorbeált (elnyelt), IR a reflektált (visszavert) fény intenzitása.
Egy-egy minta vizsgálatához az anyagi minőségnek megfelelően választunk módszert, így abszorpciós módszerrel olyan anyagokat vizsgálunk, amelynek elhanyagolható a reflexiója, tehát elsősorban folyadékok, oldatok, gázok (és csak ritkábban szilárd anyagok). Szilárd, a fényt át nem eresztő anyagok reflexiós módban vizsgálhatók.
Abszorpciós fotometriában a mintát besugárzó fény intenzitása és az áteresztett (transzmittált) fény intenzitásának különbsége adja az anyagot gerjesztő (adszorbeált) fény intenzitását. Fényt át nem eresztő minták esetében a mintát gerjesztő fényintenzitás kiszámítható a beeső és a visszavert (reflektált) sugárzás intenzitáskülönbségéből.
A mennyiségi és minőségi analízisben használt származtatott mennyiségek:
a transzmittancia T = IT / I0 ,
az abszorpció AT = IA/I0 = (I0-IT)/I0 = 1 – T ,
illetve a koncentrációmérés szempontjából sokkal fontosabb
abszorbancia A = lg (I0 / IT) = lg 1/T .
A reflexiós módszereknél a fentiekkel analóg módon
a reflektancia R = IR / I0 .
Az atomok, molekulák energiaállapotai pontosan meghatározottak,
ezért csak annak a fénynek az energiájával gerjeszthetők, melyek a két
ilyen jól definiált energiaállapot közötti átmenetet tesz lehetővé. A
fény energiája és hullámhossza között az alábbiak összefüggés írható
fel: 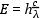 , ahol E a fényenergia (J),
c a fénysebesség (levegőben
3×108 m/s), h a
Planck-féle állandó (6.624×10-34 Js),
λ a fény hullámhossza (nm). A gyakorlati
alkalmazás szempontjából ez azt jelenti, hogy egy minta vizsgálatánál
a monokromatikus fény hullámhosszát folyamatosan változtatva
megkeressük azt a hullámhosszt, ahol a minta a gerjesztése során a
legtöbb fényt nyeli el. Így nyerhető a minta spektruma (színkép), ahol az áteresztett
(illetve a minta által visszavert) sugárzás intenzitását vagy az
ezekből számolt abszorbeált fény intenzitását ábrázoljuk a gerjesztő
sugárzás energiájának függvényében.
, ahol E a fényenergia (J),
c a fénysebesség (levegőben
3×108 m/s), h a
Planck-féle állandó (6.624×10-34 Js),
λ a fény hullámhossza (nm). A gyakorlati
alkalmazás szempontjából ez azt jelenti, hogy egy minta vizsgálatánál
a monokromatikus fény hullámhosszát folyamatosan változtatva
megkeressük azt a hullámhosszt, ahol a minta a gerjesztése során a
legtöbb fényt nyeli el. Így nyerhető a minta spektruma (színkép), ahol az áteresztett
(illetve a minta által visszavert) sugárzás intenzitását vagy az
ezekből számolt abszorbeált fény intenzitását ábrázoljuk a gerjesztő
sugárzás energiájának függvényében.
Az anyag által elnyelt sugárzás energiája, vagyis a spektrum abszorpciós maximumainak megfelelő hullámhosszak vagy hullámszámok jellemzőek az anyagi minőségre, míg az elnyelés következtében jelentkező intenzitásváltozás a mennyiségre. A spektrum energiatengelye szolgáltatja a kvalitatív analitikai információt, míg az intenzitástengely a kvantitatív analitikai tájékoztatást.
A hullámhossz alapján különféle tartományokra oszthatjuk a mérések során használt elektromágneses sugárzást (pl. fényt). A 10-380 nm hullámhossz-tartományba tartozó ultraibolya (UV) és a 380-780 nm hullámhosszú látható (VIS) sugarakkal a külső elektronhéjak és molekuláknál az ezekre szuperponált rezgési és forgási átmenetek gerjeszthetők. A kisebb energiájú infravörös (IR) (1-30 μm) és távoli infravörös (30-300 μm sugárzással) a rezgési és forgási átmenetek gerjeszthetők. Az ultraibolya és látható tartományba tartozó sugárzással járó módszereket az elektrongerjesztési spektrometria témakörébe soroljuk.
Analitikai használhatóság szempontjából az UV-VIS tartomány csak kevéssé alkalmazható kvalitatív analízisre, mivel a színképtartomány abszorpciós sávjai nagyon szélesek; a különböző csoportokra jellemző sávok egymással átfedésben lehetnek, és így nehezen rendelhetők a megfelelő funkciós csoporthoz. Ezzel szemben a kvantitatív analízis egyik legszélesebb körben használt módszere az UV-látható spektrofotometria. Alapja a Lambert-Beer-törvény, amely a kromoforkoncentráció (c) és az abszorbancia (A) közötti összefüggést írja le:
ahol I0 a beeső fény intenzitása, I az áteresztett (transzmittált) fény intenzitása, ε a moláris abszorbancia (vagyis az 1 cm vastag küvettában lévő 1 mol/dm3 koncentrációjú kromoforoldat fényelnyelése), l a rétegvastagság (küvettahossz), c a kromofor, illetőleg a mérendő anyag koncentrációja.
A Lambert-Beer alkalmazásakor figyelembe kell venni az alábbiakat:
A Lambert-Beer-törvény csak híg oldatokra érvényes (10-3 mol/dm3 koncentrációig). Töményebb oldatoknál az oldat törésmutatója (n) is megváltozik, amellyel korrigálni szükséges az egyenletet:
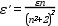 Ilyen esetben a Lambert-Beer-törvényben
ε helyett ε’
szerepeltetendő.
Ilyen esetben a Lambert-Beer-törvényben
ε helyett ε’
szerepeltetendő.A kromofor csoportot hordozó molekula kémiai reakciói (molekulák disszociációja, asszociációja, protonálódása, komplexképződése stb.) is okozhatnak a Lambert-Beer-törvénytől való eltérést.
Az oldószercsere a molekulák energiaállapotait megváltoztatja. Különböző szinten stabilizálják egy adott molekula alap és gerjesztett állapotát, megváltozik a gerjesztéshez szükséges energia, így abszorpciós spektrum is.
A Lambert-Beer-törvény csak monokromatikus sugárzásra érvényes. A monokromatikus fényt létrehozó eszközök különböző sávszélességet képesek elérni. A nagyobb sávszélesség akkor okozhat eltérést, ha az abszorpciós spektrum meredek (emelkedő vagy leszálló) szakaszán végezzük a mérést. A mérés során a monokromátor által megszabott szélességű sávokból gyűjti az átlagos abszorbanciaértéket. A színkép meredek szakaszán mért átlagos abszorbancia jelentősen eltérhet a pontosan adott monokromatikus fénnyel nyert abszorbanciától. E hiba kiküszöbölésére célszerű a színkép elnyelési maximumának helyén (lapos szakasz) végezni a koncentrációmérést.
. A Lambert-Beer-törvény csak molekuláris oldatokra érvényes. A kolloid részecskék által okozott fényszórás jelentős hibát okozhat.
Az abszorbanciát a rendszer hőmérséklete is befolyásolhatja az elektronátmenetek energiájának változása miatt. Ez az elnyelési sávok helyének, esetleg alakjának és intenzitásának megváltozásával jár. Tehát csak az azonos hőmérsékleten végzett mérések adatai hasonlíthatók össze.
Fontos megjegyezni, hogy a Lambert-Beer-törvény érvényességi tartományában az abszorbancia additív tulajdonság. A vizsgálatoknál alkalmazott hullámhossznál elnyelő, egymás mellett előforduló komponensek fényabszorpciója összeadódik.
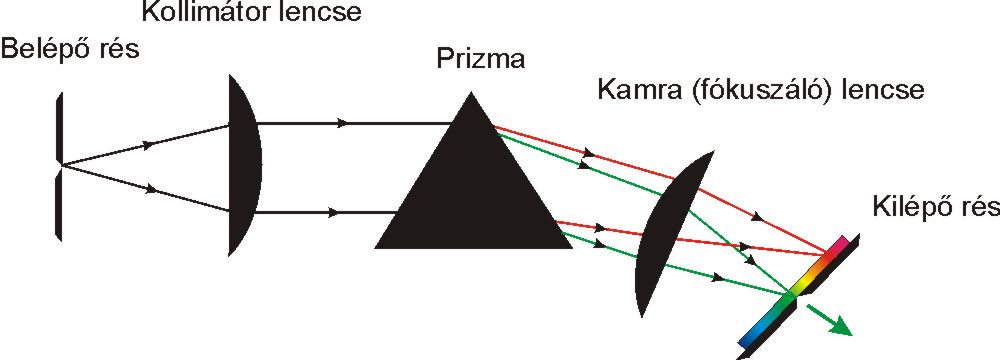
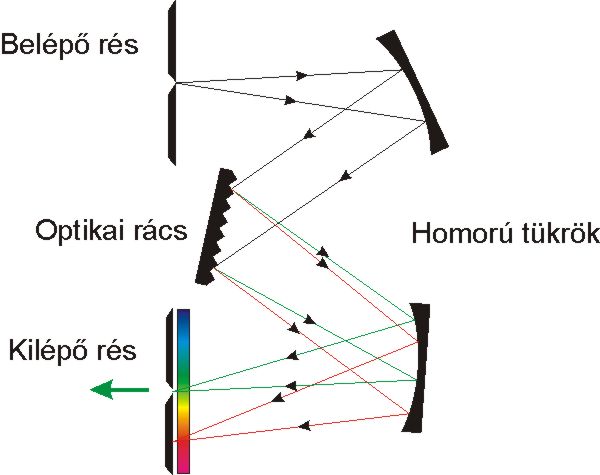
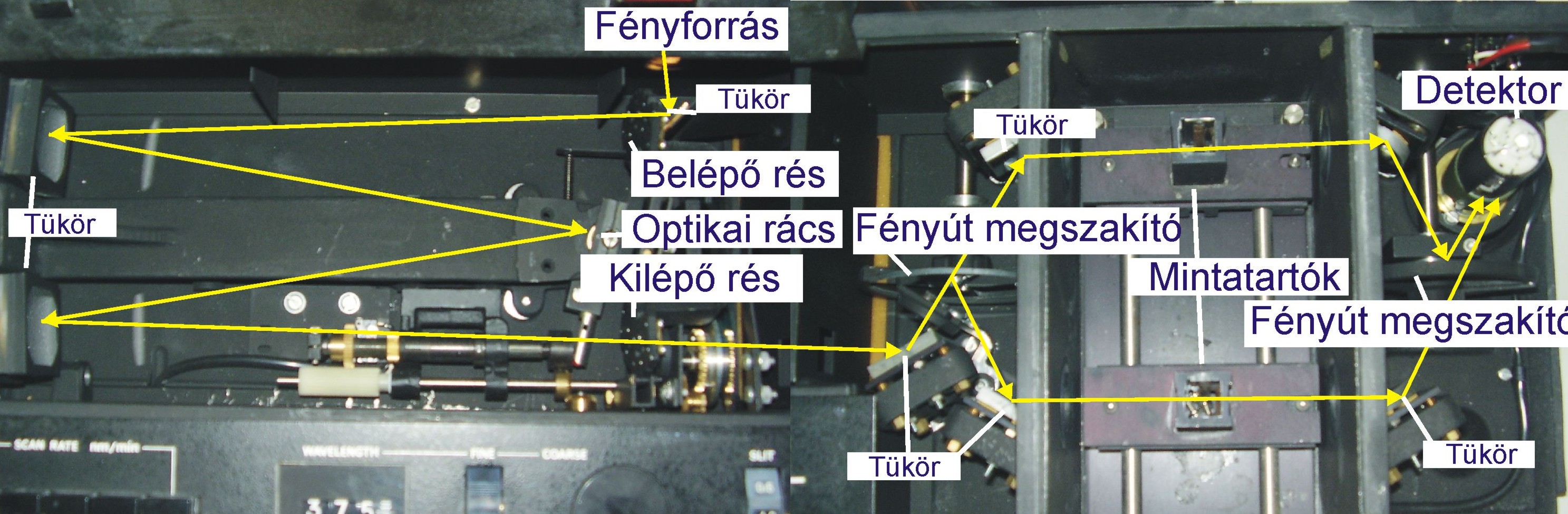
A fényabszorpció mérésekre alkalmas spektrofotométerek blokksémáját a 4.5. ábra mutatja. Működési elvük, hogy a mérés alapjául szolgáló fény a fényforrásból a monokromátorba jut, amely azt monokromatizálja (szűk hullámhossztartományú fénnyalábol állít elő), és folyamatosan választja ki a kívánt hullámhosszúságú sugárzást. Ez a sugárzás a mintatartóban elhelyezett mintán halad keresztül, majd a detektorba kerül, amely különböző hullámhosszúságú sugarak intenzitását méri és regisztrálja.
A spektrofotométereket osztályozhatjuk
a mérés hullámhossz tartománya szerint ultraibolya, látható és infravörös tartományban működő
a fényfelbontás módja szerint prizmás, rácsos, szűrős
a működési elv, illetve a felépítés szerint egyfényutas és kétfényutas készülékek.
Egyfényutas spektrofotométeren egymást követően mérjük le a kromofort tartalmazó analitikai minta és a kromoformentes, de egyébként azonos összetételű összehasonlító oldat (vak) fényabszorpcióját.
A kétfényutas spektrofotométerek esetén a monokromátor után megfelelő tükrök segítségével a fénysugarat két egyforma részre bontjuk, amelyek közül az egyik a mintán, a másik a mérendő komponenst nem tartalmazó, de azzal azonos összetételű referenciaanyagon halad keresztül. Ezt követően a fénysugarak a két sugárútból váltakozva kerülnek az érzékelő, majd regisztráló berendezésre. Ez a fényváltás forgó tükörrel, fényút megszakítóval történik.
A fenolos OH- csoport komplexképző sajátságai. A hidroxilcsoportot tartalmazó szerves vegyületek jól ismert és széles körben elterjedt komplexképzők. Nagy jelentősége van azoknak, amelyek egymáshoz közel fekvő –OH csoportokat (pirokatechin) vagy egy –OH és egy –COOH csoportot tartalmaznak (szalicilsav). Ezek számos fémmel nagy stabilitású belső komplex vegyületeket alkotnak, így azok mennyiségi meghatározására is alkalmasak.
A vas komplexképzése szulfoszalicilsavval. A szulfoszalicilsav a vas(III)-ionokkal színes komplexet alkot, amelynek fényelnyelése mérhető és arányos a vas(III)-ionok koncentrációjával. A Fe3+- ion szulfoszalicilsavval többféle komplexet alkot.
Savas közegben pH = 1,8 - 2,5 között barnás-rózsaszínű [Fe(Sal)]+ kation keletkezik.
pH= 4 - 8 között vörösbarna [Fe(Sal)2]- komplex keletkezik
pH = 8 - 11,5 között sárga színű [Fe(Sal)3]3- komplex anion keletkezik.
Sal2- a szulfoszalicilsav anionját
jelenti: 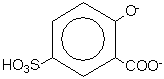
Savas közegben a Fe3+ zavaró ionok (Al3+, Mn2+, Cu2+ stb.) mellett is meghatározható, viszont a [Fe(Sal)]+ komplex kevésbé állandó. Ha a zavaró ionok mennyisége nem nagy, a meghatározást célszerű pH = 4,5 - 7 között végezni. Az ilyenkor keletkező [Fe(Sal)2]- komplexek ugyanis szélesebb pH tartományban sem bomlanak. A színintenzitás mérésére a spektrofotométer könnyen alkalmazható.
Anyagok:
-
250 μg/ml Fe3+-oldat - 0,1 M perklórsav
(HClO4) - 0,01 M szulfoszalicilsav
Eszközök:
- 8 db 100,00
cm3-es merőlombik - osztott pipetta
(5,00 cm3) -
mérőhenger
A gyakorlat menete: Osztott pipetta segítségével az ismert koncentrációjú (250 μg/ml) Fe3+-törzsoldatból 1, 2, 3, 4, 5, 6 cm3-t 100,00 cm3-es mérőlombikokba mérünk, hozzáadunk mérőhengerben kimért 30,00 cm3 0,01 M-os szulfoszalicilsavat, majd 0,1 M-os HClO4-val jelig töltjük (ez lesz a kalibráló oldatsor). Az ismeretlen koncentrációjú Fe3+-oldatot tartalmazó 100 cm3-es merőlombikba az előzőekhez hasonlóan előbb szulfoszalicilsavatat adunk, majd HClO4-val jelig töltjük. A nullázó oldat (vak) készítésekor 30,00 cm3 szulfoszalicilsavat mérünk ki egy 100,00 cm3-es mérőlombikban és perklórsavval jelre töltjük. Az oldatokat 30 percig állni hagyjuk.
Ezután a 4,00 cm3 Fe3+-törzsoldatot tartalmazó oldattal felvesszük a Fe3+ spektrumát 450-550 nm között, 5 nm-enként leolvasva az abszorbanciát. Referencia oldatként a nullázó oldatot használjuk. A mért maximális abszorbanciához tartozó hullámhosszon mérjük meg a kalibráló oldatsor és az ismeretlen Fe3+-oldat abszorbanciáját. Végezzünk mintánként három párhuzamos mérést!
Kiértékelés:
Ábrázoljuk a vas(III)-szulfoszalicilsav komplex abszorbciós spektrumát milliméterpapíron!
Ábrázoljuk a koncentráció (a kalibráló oldatsor koncentrációi) függvényében az abszorbanciát. Az így kapott pontokra illesszünk egyenest manuálisan, illetve számoljuk ki a pontokra a legkisebb négyzetek módszerével illeszthető egyenes egyenletét. (lásd Az analitikai mérőgörbe meghatározása c. fejezetben)
Adjuk a meg a mintánk koncentrációját az illesztett egyenes egyenlete segítségével és a mérés reprodukálhatóságát!
Anyagok: - 0,25 M-os NiSO4-oldat
Eszközök:
- 6 db 100,00 cm3-es merőlombik - hasas
pipetta (10,00 cm3) - osztott pipetta
(10,00 cm3)
A gyakorlat menete: Az ismeretlen koncentrációjú NiSO4-oldatot a 50,00 cm3-es mérőlombikban desztillált vízzel jelre töltjük. Ebből az oldatból 10,00 – 10,00 cm3 –t kiveszünk a 100,00 cm3-es mérőlombikokba (6 db).
| A (405) | ||
| 1. lombik | 10,00 cm3 ismeretlen konc. oldat, amelyet jelre töltünk desztillált vízzel |
|
| 2. lombik | 10,00 cm3 ismeretlen konc. oldat + 10, 00 cm3 0,25 M -os NiSO4 → jelre töltjük |
|
| 3. lombik | 10,00 cm3 ismeretlen konc. oldat + 11, 00 cm3 0,25M -os NiSO4 → jelre töltjük |
|
| 4. lombik | 10,00 cm3 ismeretlen konc. oldat + 12, 00 cm3 0,25 M -os NiSO4 → jelre töltjük |
|
| 5. lombik | 10,00 cm3 ismeretlen konc. oldat + 13, 00 cm3 0,25 M -os NiSO4 → jelre töltjük |
|
| 6. lombik | 10,00 cm3 ismeretlen konc. oldat + 14, 00 cm3 0,25 M -os NiSO4 → jelre töltjük |
|
Mérjük le az így elkészített oldatok abszorbanciáját 405 nm-en. Számoljuk ki az egyes lombikokban lévő NiSO4 oldatok koncentrációját (figyelmen kívül hagyva az ismeretlen oldat koncentrációját).
Kiértékelés:
A koncentráció függvényében ábrázoljuk a mért abszorbanciát!
A mérési pontokra illesztett egyenes alapján olvassuk le az eredeti ismeretlen oldat koncentrációját (figyelembe véve az oldat hígítását)!
Anyagok: - 10-3m/m %-os metilénkék oldat
Eszközök:
- kémcsövek - osztott pipetta (10,00
cm3)
A gyakorlat menete: Első lépésben felvesszük a 10-3m/m %-os metilénkék oldat spektrumát 530 és 700 nm között 5 nm-enként leolvasva az abszorbanciát. A kapott értékeket grafikusan ábrázoljuk. A maximális abszorbanciához tartozó hullámhosszon mérjük meg a kalibráló oldatsor és az ismeretlen oldat abszorbanciáját.
Kalibráló oldatsorozat készítése: Hat kémcsövet megszámozunk, az 1-es számú kémcsőbe bemérünk 4 ml 10-3m/m %-os metilénkék oldatot és feltöltjük 10 ml-re. A következő kémcsövekbe (2-6) bemérünk 5-5 ml desztillált vizet, ezután az 1-es számú kémcsőből 5 ml-t bemérünk a 2-es számú kémcsőbe. Összekeverés után a 2-es számú kémcsőből 5 ml-t bemérünk a 3-as számú kémcsőbe, majd a 3-asból összerázás után 5 ml-t a 4-esbe stb.
Kiértékelés:
Ábrázoljuk a metilénkék abszorbciós spektrumát milliméterpapíron!
Ábrázoljuk az ismert koncentrációkhoz tartozó abszorbancia értéket (kalibrációs egyenes)!
A mérési pontokra illesztett egyenes (lásd Az analitikai mérőgörbe meghatározása c. fejezetben) segítségével határozzuk meg az ismeretlen oldat metilénkék koncentrációját!
UV, VIS, IR, abszorbancia, reflektancia, transzmittancia, spektrum, monokromatikus fény
Mi a spektrum?
Hogyan hajt végre kalibrálást standard addíciós eljárással?
Röviden (!) részletezze, mely tényezők korlátozzák a Lambert-Beer tv. alkalmazását?
Rajzolja le egy egyutas fotométer blokksémáját. Adja meg az egyes egységek elnevezését és ismertesse funkciójukat!