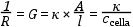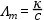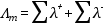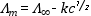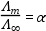A konduktometriás méréstechnika elvének és gyakorlatának megismerése. A konduktometria alkalmazása tirálások végpontjelzésére.
Elektrolit oldatok vezetőképességét konduktometriás módszerekkel mérhetjük. A vezetőképesség direkt értékéből ill. a kémiai reakciók hatására bekövetkező változásából nyerhetünk analitikai információkat. A vezetőképesség (G, mértékegysége S (siemens)) az ellenállás (R, mértékegysége Ω (ohm)) reciproka. A vezetést az oldatban jelenlévő, elektromos erőtérben elmozduló töltéshordozók (elektronok, ionok) hozzák létre, így megkülönböztetünk vezető, ill. szigetelő anyagokat. Vizes oldatokat vizsgálva a víz autoprotolízisének termékei csak nagyon kis mértékben járulnak hozzá a vezetéshez, ezért a tiszta víz szigetelőnek tekinthető. Az oldott anionok és kationok koncentrációjától, valamint a disszociáció mértékétől függően azonban jelentősen megnövekedik a vezetés, az oldatok vezetők lesznek.
Az elektromos tér hatására az oldatban kialakuló ionvándorlás az oka az oldatok elektromos vezetésének. Additív tulajdonság, amelynek mértékét az oldatban jelenlevő összes ion határozza meg. A konduktometria ezért nem szelektív módszer. Csak olyan oldatok vizsgálhatók vele, amelyek csak egy elektrolitot tartalmaznak, vagy a vizsgálandó elektrolit koncentrációváltozása illetve ionjainak mozgékonyság-változása jelentős mértékű a háttérelektrolit vezetőképességéhez mérten. Ezért a módszer kiválóan alkalmas, pl. acidi-alkalimetriás titrálások végpontjelzésére.
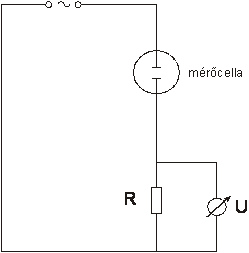
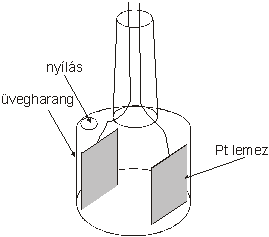
A vezetőképesség mérésére vezetőképességi cellát használunk, leggyakrabban harangelektródot. Ebben két platina lemez helyezkedik el egymással szemben. Ha a lemezek felülete (A) 1 cm2 és a köztük lévő távolság (l) 1 cm, a kialakult 1 cm3 térben mérhető vezetőképesség értéket fajlagos vezetőkésségnek (κ[ S cm-1]) hívjuk.
A cellában a lemezekre 800-5000 Hz közötti frekvenciájú váltakozó feszültséget kapcsolnak, megakadályozandó a vizsgálandó anyag polarizációját. A konduktométer alábbi, 3.6.ábrán található elvi sémája alapján belátható, hogy a konduktometriás mérések ellenállásmérésre vezethetők vissza.
A fajlagos vezetőképesség értékek különböző, nem standard méretű, formájú cellában mért értékeinek összehasonlíthatóságát szolgálja a cellaállandó (Ccella[cm/cm2]) meghatározása, melyet ismert vezetőképességű oldatokban lehet elvégezni.
Ha a fajlagos vezetőképességet elosztjuk a koncentrációval, megkapjuk a moláris fajlagos vezetőképességet (Λm [cm2Ω-1 mol-1])
Kohlrausch első törvénye szerint az anionok és kationok egymástól függetlenül járulnak hozzá az elektromos vezetéshez, vagyis a moláris fajlagos vezetőképesség a kationok és anionok moláris fajlagos vezetőképességének összege. Erős elektrolitok esetén ezért:
ahol
Σλ+= a
kation moláris fajlagos vezetőképessége
[cm2Ω-1
mol-1]
Σλ-= az anion moláris fajlagos
vezetőképessége
[cm2Ω-1
mol-1]
A 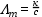 egyenlet szerint a moláris fajlagos
vezetőképességnek függetlennek kellene lennie a koncentrációtól. Ez
azonban csak végtelen híg oldatokra igaz, ugyanis csak ilyen
oldatokban mozognak egymástól teljesen függetlenül az ionok. Az itt
mért vezetőképesség adat az adott ionokra jellemző állandó, csak az
oldószertől és a hőmérséklettől függ. Erős elektrolitoldatok esetén a
moláris fajlagos vezetőképesség koncentrációfüggését Kohlrausch
második törvénye írja le:
egyenlet szerint a moláris fajlagos
vezetőképességnek függetlennek kellene lennie a koncentrációtól. Ez
azonban csak végtelen híg oldatokra igaz, ugyanis csak ilyen
oldatokban mozognak egymástól teljesen függetlenül az ionok. Az itt
mért vezetőképesség adat az adott ionokra jellemző állandó, csak az
oldószertől és a hőmérséklettől függ. Erős elektrolitoldatok esetén a
moláris fajlagos vezetőképesség koncentrációfüggését Kohlrausch
második törvénye írja le:
Λ∞ =
a végtelen híg oldat moláris fajlagos vezetőképessége
[cm2Ω-1mol-1]
c = az elektrolit koncentrációja
[mol/dm3] k = állandó
[mol/dm3]-1/2
Elsősorban az ionok közötti kölcsönhatások felelősek azért, hogy az elektrolit koncentrációjának növekedésével csökken a fajlagos vezetőképesség.
Gyenge elektrolit esetén a Λm moláris fajlagos vezetőképesség erősen függ az ionok disszociációjától. Egy „c” koncentrációjú és a végtelen híg oldatban mért moláris fajlagos vezetőképességek hányadosa a disszociációfokkal (α) egyezik meg.
A konduktometriában megkülönböztetünk közvetlen koncentrációmérést (direkt konduktometriát) és a konduktometriás titrálást (indirekt konduktometria). Előbbinél az oldat vezetőképességéből következtethetünk annak koncentrációjára. A direkt konduktometria jól bevált desztillált vagy ioncserélt víz, vagy más oldószer ionmentességének ellenőrzésére is. Ebben az esetben nem az oldatban lévő elektrolit koncentrációját mérik, hanem az elektrolitmentességet, azaz a desztilláció vagy ioncsere eredményességét.
A vezetőképesség mérés minden olyan reakción alapuló titrálás végpontjának jelzésére alkalmas, amely az ionkoncentráció változtatásával, vagy azonos koncentráció mellett különböző mozgékonyságú ionok cseréjével jár. Ezek az indirekt koduktometriás mérések.
Sav-bázis titrálások esetén a konduktometriás végpontjelzést megkönnyíti, hogy az összes ion közül a hidrogénionok mozgékonysága a legnagyobb, ezt követi a hidroxidionok mozgékonysága, amely még mindig meghaladja a legtöbb egyéb ion mozgékonyságát.
Ha például sósavat titrálunk nátrium-hidroxid-mérőoldattal, a titrálásnak az ekvivalenciapont előtti részén a sósav semlegesítése nem jár koncentrációváltozással (ha a hígulást figyelmen kívül hagyjuk!), hiszen minden semlegesített hidrogénion helyébe nátriumion kerül oldatba, mégis a hidrogénionoknak a nátriumionokénál nagyobb mozgékonysága miatt a vezetőképesség csökken. A végpont után már két oka van a vezetőképesség növekedésének. A lúgfelesleg az oldat összion-koncentrációját növeli, ami annál inkább jelentkezik, mivel a hidroxidionok mozgékonysága nagyobb, mint a rendszerben lévő többi ioné. Ennek a titrálásnak a konduktometriás titrálási görbéje látható a 3.8. ábrán.
A görbe ekvivalenciapont előtti szakaszának a meredeksége valamint az ekvivalenciapont utáni szakasz meredeksége eltérő, amelynek oka a hidrogénionok és hidroxidionok mozgékonysága közötti különbség.
Minden olyan titrálás, amelynek során a rendszer vezetőképessége a meghatározandó komponens koncentrációváltozásával arányosan változik, konduktometriás végpontjelzés mellett elvégezhető. Az eljárást úgy hajtjuk végre, hogy a mérőoldat egyes részleteinek hozzáadása után az oldat vezetőképességét megmérjük. Mivel a vezetőképesség és a mérendő anyag koncentrációja között az összefüggés közel lineáris, a vezetőképesség-értékeket a mérőoldat térfogatának függvényében ábrázolva lineáris szakaszokból álló titrálási görbét nyerünk, amelyeken a végpontot a görbék töréspontja jelzi. Így nincs szükség arra, hogy a titrálási görbét sok pontból szerkesszük meg és az ekvivalenciapont közelében vegyünk fel minél több mérési pontot.
Mérőoldat: 0,1 M faktorozott sósav-mérőoldat
Eszközök, anyagok: 0,1 M faktorozott sósav-mérőoldat; 10,00 cm3 nátrium-hidroxid-oldat; 150,00 cm3-es főzőpohár; büretta; mágneses keverő; konduktométer
A gyakorlat menete: Mérjünk be 10,00 cm3 meghatározandó oldatot a főzőpohárba és egészítsük ki desztillált vízzel kb. 75 cm3-re. Kapcsoljuk be a mérőműszert, helyezzük az elektródot az ismeretlent tartalmazó oldatba. Töltsük fel a bürettát faktorozott 0,1 M HCl oldattal. Titráljuk meg az ismeretlen koncentrációjú oldatot, jegyezzük fel az egyes mérőoldat-mennyiségek adagolása után a vezetőképesség értékeket. Ábrázoljuk a mért értékeket a fogyott mérőoldat térfogatának függvényében! Illesszen egyenest a mérőgörbe megfelelő pontjaira, (lásd Az analitikai mérőgörbe meghatározása c. fejezetben), a két egyenes metszéspontjából számítsa ki az egyenértékpontot.
A jegyzőkönyvnek tartalmaznia kell:
A gyakorlat rövid leírását
A mért értékek táblázatos összefoglalását
A konduktometriás titrálási görbét
A titrálási adatok feldolgozását, a számolás menetét (mértékegységek hanyagolása tilos!)
Az ismeretlen NaOH oldat koncentrációját.
A víz változó keménységét a vízben oldott kalcium-és magnézium-hidrogén-karbonát adja. A vízminta sósavfogyasztása tehát a minta kalcium-és magnézium-hidrogén-karbonát tartalmával magyarázható:
Ca(HCO3)2 + 2 H+(aq) + 2 Cl-(aq) = 2H2O + 2CO2 + Ca2+(aq) + 2 Cl-(aq)
Mg(HCO3)2 + 2 H+(aq) + 2 Cl-(aq) = 2H2O + 2CO2 + Mg2+(aq) + 2 Cl-(aq)
Az egyenletek alapján láthatjuk, hogy a titrálás folyamán a vezetőképesség nő. A hidrogén-karbonátok reagálása után -ami egy sav-bázis reakció- a titrálószer ionjai azok, amelyek a vezetőképességet tovább növelik. Az utóbbi esemény adja a titrálási görbe második egyenes szakaszát. Az első szakasz azért mutat vezetőképesség-növekedést, mert az oldatba kloridionok kerülnek, valamint a kalcium-és magnézium - hidrogén-karbonát molekulák reagálásából szabadon mozgó kalcium-illetve magnéziumionok is kerülnek az oldatba. A Ca(HCO3)2 és a Mg(HCO3)2 rosszul disszociáló vegyület: az oldat szabad kalcium- és magnéziumion valamint hidrogén-karbonát-ion tartalma kicsi. A sósav többnyire a kalcium- illetve magnézium-hidrogén-karbonát molekulákkal reagál.
Mérőoldat: 0,1 M faktorozott sósav-mérőoldat
Eszközök, anyagok: 100,00 cm3 csapvíz, 250,00 cm3-es főzőpohár, büretta, mérőhenger, mágneses keverő, konduktométer
A gyakorlat menete: Előzőleg jól kifolyatott csapvízből mérőhengerrel mérjünk ki 100,00 cm3 hálózati vízmintát és mérjük meg a vezetőképességét. Mossuk ki alaposan a bürettánkat desztillált vízzel, majd öblítsük át a mérőoldatunkkal (0,1 mol/dm3 koncentrációjú faktorozott HCl-oldattal)! Mágneses keverő segítségével biztosítsuk az oldat állandó keverését a mérés folyamán! A büretta feltöltése után titráljuk meg a vízmintánkat a 0,1 mol/dm3-es mérőoldatunkkal 1 cm3-enként és olvassuk le minden mérőoldat adagolás után a vezetőképességet! A titrálást kétszer végezzük el! Ábrázoljuk a vezetőképességet a mérőoldat fogyásának a függvényében és olvassuk le a görbéről a víz változó keménységére fogyott HCl-mérőoldat fogyását! Számítsuk ki a víz változó keménységét német keménységi fokokban megadva! (Emlékeztetőül: 1 német keménységi fokú az a víz, melynek 1 dm3-ében 10 mg CaO-al egyenértékű kalcium-, illetve magnézium só van feloldva.)
A jegyzőkönyvnek tartalmaznia kell:
A gyakorlat rövid leírását
A mért értékek táblázatos összefoglalását
A konduktometriás titrálási görbét
A titrálási adatok feldolgozását, a számolás menetét (mértékegységek hanyagolása tilos!)
Az ivóvíz változó keménységét német keménységi fokokban
Bárium-szulfát csapadék képződésén keresztül határozzuk meg oldatok szulfát koncentrációját indirekt konduktometriával.
Mérőoldat: 0,05 M BaCl2 merőoldat
Eszközök, anyagok: 100,00 cm3 mintaoldat, izopropil-alkohol, 100,00 cm3-es főzőpohár, büretta, mérőhenger, mágneses keverő, konduktométer
A gyakorlat menete: Töltse fel jelig a kiadott merőlombikot, majd 20,00 cm3-t pipettázzon ki belőle egy 100,00 cm3-es magas főzőpohárba. Ebben végzi majd el a titrálást. Adjon hozzá kb. 60 cm3 ioncserélt vizet (hogy ellepje a harangelektródot) és 10,00 cm3 izopropil-alkoholt (utóbbit a csapadék oldódásának visszaszorítására). Mágneses keverőn folyamatosan kevertesse az oldatot a mérés folyamán. Bürettából 1,00 cm3-es adagokban adjon a mintához 0,05 mol/dm3 BaCl2 merőoldatot, majd a mért értékek állandósulása után jegyezze fel a vezetőképességet. Háromszor végezze el a mérést!
A mérőoldat térfogat és mért vezetőképesség értékekből szerkessze meg a titrálási görbét, illesszen egyenest a görbe megfelelő szakaszaira (lásd Az analitikai mérőgörbe meghatározása c. fejezetben) és a két egyenes metszéspontjából számítsa ki az egyenértékpontban fogyott mérőoldat mennyiségét. Számítsa ki mg/100 ml egységben a kiadott ismeretlen SO42- koncentrációját!
Beadandók: titrálási görbék, számítások, ismeretlen SO42- koncentrációja.
Mérőoldat: 0,05 M BaCl2 merőoldat
Eszközök, anyagok: 100,00 cm3 mintaoldat, izopropil-alkohol, 100,00 cm3-es főzőpohár, büretta, mérőhenger, mágneses keverő, konduktométer
A gyakorlat menete: Az előzőekben leírt módon hajtsa végre a méréseket, az alábbi változásokkal: 2 cm3 mintához 1 cm3-enként adagolja a mérőoldatot. 20 cm3 mérőoldatot adagoljon összesen. Számítsa ki a gyógyvíz szulfátion koncentrációját mg/l egységekben. A kapott értéket hasonlítsa össze a gyógyvíz palackján feltüntetett értékkel!
Beadandók: titrálási görbék, számítások, gyógyvíz SO42- koncentrációja.
Mérőoldat: 0,1 M faktorozott sósav-mérőoldat
Eszközök, anyagok: citromsav ismeretlen, 50,00 cm3 -es mérőlombik, 150,00 cm3 -es főzőpohár, büretta, mágneses keverő, konduktométer
A gyakorlat menete: A kiadott citromsav ismeretlenből mérjen ki 10,00 cm3-t egy 150 cm3-s főzőpohárba, majd adjon hozzá kb. 70 cm3d.vizet. Titrálja meg a mintát 0,1 M-os NaOH oldattal. Mágneses keverőn folyamatosan kevertesse az oldatot a mérés folyamán. Bürettából 1 cm3-s-es adagokban adagoljon a mintához merőoldatot, majd a mért értékek állandósulása után jegyezze fel a vezetőképességet. Háromszor végezze el a mérést!
A mérőoldat térfogat és mért vezetőképesség értékekből szerkessze meg a titrálási görbét, illesszen egyenest a görbe megfelelő szakaszaira és határozza meg az egyenérték pontban fogyott mérőoldat mennyiségét. Számítsa ki a minta citromsav koncentrációját mg/100 cm3egységben.
Beadandók: titrálási görbék, számítások, citromsav ismeretlen koncentrációja mg/100 cm3 egységben.
Mi a moláris fajlagos vezetőképesség?
Mi a fajlagos vezetőképesség?
Milyen összefüggést ismer az ionok mozgékonysága, a közeg hőmérséklete, illetve a vezetőképesség között?
Milyen kémiai folyamatok követhetők konduktometriával?
Miért követhetők sav-bázis titrálások konduktometriával?