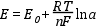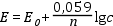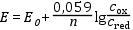Tartalom
Az elektroanalitikai eljárások közé azok az analitikai módszerek tartoznak, ahol egy elektrokémiai cellában lévő minta meghatározását végezzük feszültség és/vagy áram mérésén keresztül. Attól függően, hogy az elektrokémia folyamat során melyik paramétert szabályozzuk, illetve mérjük, számos módszert különíthetünk el. Az elektroanalitika három legfontosabb, leggyakrabban alkalmazott ága a potenciometria (elektródpotenciál különbség mérése), coulombmetria (a cellán átfolyó áram mérése az idő függvényében) és a voltammetria (a cella potenciálját szabályozva mérjük az áramot).
Az elektrokémia vizsgálatokhoz a mérőcellában lévő mintába merülő elektródokat használunk. A mérések típusától függően 2-4 elektródot alkalmazunk. Funkciójuk alapján elkülönítünk a) munka- vagy indikátorelektródot, b) vonatkozási- vagy referenciaelektródot és c) segédelektródot.
A potencoimetriás analízis gyakorlatának megismerése. Az elektródpotenciál és a pH közötti összefüggések megismerése és alkalmazása. Térfogatos analízis elvégzése potenciometriás végpontjelzéssel.
A potenciometria egy elektroanalitikai eljárás, mely az elektrolitoldatba merített elektródok felületén kialakuló elektródpotenciálok különbségének mérésén alapul. Az elektrokémiai cella (ez esetben galváncella) egy indikátor- és egy referenciaelektródból áll, e két félcella közötti feszültséget mérjük, miközben áram nem folyik át a cellán.
A pontos mérésekhez szükséges, hogy a referencia (viszonyító)elektródok potenciálja a mérés során közel állandó legyen, ugyanis ekkor a mért elektródpotenciál különbség csak az indikátor elektródon kialakuló potenciálból származik, vagyis az elektródaktív anyag koncentrációjával (aktivitásával) arányos. A referencia elektródok többnyire másodfajú elektródok, a gyakorlatban Ag/AgCl vagy Hg/Hg2Cl2 elektródokat használunk. A másodfajú elektródok egy fémből, a fém rosszul oldódó sójából, valamint a só anionjának nagy koncentrációjú oldatából állnak.
Indikátor elektródként elsőfajú fémelektródokat vagy 1-1 ionra (v. molekulára) szelektív elektródokat használunk, melyek lehetnek ionszelektív-, gáz-, redoxi-, enzimelektródok.
Az elektródpotenciál (E) és az azt létrehozó elektródaktív komponens koncentrációja közötti összefüggést a Nernst-egyenlet írja le:
ahol, E0 a rendszer standard potenciálja, R az egyetemes gázállandó,T a termodinamikai hőmérséklet, n az adott elektródfolyamat elektronszám-változása, F a Faraday-állandó (96487 Coulomb/mol) és a az elektródaktív komponens aktivitása (mol/dm3).
A gyakorlatban az egyenletet tízes alapú logaritmikus formában használjuk (25 şC-on):
Redoxi rendszerek esetén a Nernst-Peters egyenlettel írható fel az elektródpotenciál:
ahol cox ill. cred a vizsgált redoxi rendszerben lévő minta oxidált ill. redukált formájának analitikai koncentrációja.
Egyetlen elektród felületén kialakuló potenciált közvetlenül nem lehet mérni. Ezért a mérés során a vizsgálandó komponens koncentrációja által az indikátorelektródon meghatározott potenciáljának és egy viszonyító (referencia) elektród konstans potenciáljának a különbségét mérjük. Mivel a viszonyító elektród pontos potenciálja sem mérhető, a potenciometriás mérés útján mindig csak potenciálkülönbségek mérésére van módunk, ezekből a potenciálkülönbségekből kell - alkalmas kalibráció segítségével - az analitikai információhoz jutnunk.
A különböző elektródokkal mért elektródpotenciál-értékek összehasonlítását az teszi lehetővé, hogy a normál-hidrogénelektród (platinafém 1,0 mol/dm3 koncentrációjú sósavoldatba merül és felette 0,1 MPa nyomású hidrogéngáz helyezkedik el) potenciálját zérusnak tekintjük. Referenciaelektródként a normál-hidrogénelektródot ritkán használjuk, azonban a gyakorlatban használt referenciaelektródok potenciálját a normál-hidrogénelektródra vonatkoztatva átszámíthatjuk.
A referenciaelektród potenciáljának változatlan értéken tartásához az elektród belső töltőoldatának koncentrációját a mérés során állandó értéken kell tartani. Ehhez a viszonyító elektródot tartalmazó félcellát az indikátorelektródot tartalmazó félcellától elválasztjuk és csak valamilyen oldatcsatlakozáson (sóhíd) keresztül kapcsolódnak egymáshoz. Az oldatcsatlakozás egy folyadék-folyadék határfelület, ahol ugyancsak felléphet potenciálkülönbség, amelyet diffúziós potenciálnak nevezzük.
A teljes mértékben ki nem küszöbölhető diffúziós potenciál a mérés pontosságát ronthatja, ezért törekedni kell minél kisebb értéken tartására. E célból az indikátorelektródot és a referenciaelektródot tartalmazó félcellákat sóhíddal kötik össze. A sóhíd készítésnél olyan só vizes oldatát használjuk, ahol az anion és a kation közel azonos mozgékonyságú (pl.: KCl, KNO3, esetleg NH4NO3). Ezért a határfelület felé történő diffúzió során a kation közel azonos sebességgel halad, így felületi töltésfeldúsulás nem figyelhető meg. Rendkívül fontos, hogy a sóhídban előforduló só koncentrációja a vizsgálandó oldat, valamint a referenciaelektród környezetét képező oldat koncentrációjánál nagyobb legyen, így a sóhíd mindkét végén kifelé, az oldatok felé irányuló diffúzió van. Ezért a két határfelületen fellépő diffúziós potenciálok előjele ellentétes lesz, többé-kevésbé kompenzálják egymást.
A potenciometriás titrálások során használt elektrokémiai cella feszültsége tehát három tagból tevődik össze: a meghatározandó komponens koncentrációja által megszabott, az indikátorelektródon fellépő Ei potenciálból, a referenciaelektródnak a mérés során konstans értéken tartott Ev potenciáljából, valamint a lehetőségekhez képest kis konstans értéken tartott Ed diffúziós potenciálból.
E= Ei - Ev + Ed
ha Ei és Ev azonos előjelű.
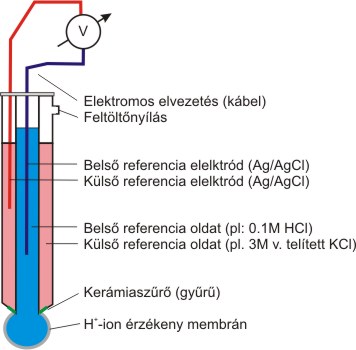
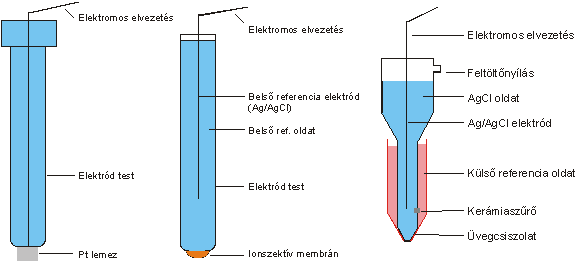
A pH-érzékeny üvegelektród az oldatok pH-jának meghatározására leggyakrabban használt elektródtípus. Mérési tartománya pH 1-13 közé esik. Szerkezetének legfontosabb eleme egy vékony üveggömb, melyben ioncsere-egyensúly alakul ki az oldat H+-jaival. Az üveggömb belső oldalát pufferelt közegbe helyezve (állandó H+ koncentráció!), a két oldal között kialakuló H+ koncentráció aránya csak a külső (minta) oldattérben lévő H+ koncentrációtól függ, így az üveg két oldala között kialakuló potenciálkülönbség a minta hirdogén-ion koncentrációjával lesz arányos. A napjainkban használt kombinált üvegelektródokban a hagyományos üvegelektród-test köré egy referencia elektródot építenek még fel. (3.1. ábra)
A pH meghatározásánál a mérés előtt a pH mérőt két kalibráló (puffer) oldatot használva beállítjuk, úgy, hogy az ismert pH-jú kalibráló oldatban mért potenciálkülönbséghez a kalibráló oldat pH értéket rendeljük hozzá. Ezt követően a műszer a pontos pH-t mutatja. (Ez a lépés a kalibráló görbe felvételének megfelelő). A kalibráló oldatok kiválasztásánál előnyös, ha a vizsgálni kívánt oldat pH-ját a kalibráló oldatok pH-ja közrefogja.
3.2. ábra - Potenciometriás analízishez használt néhány elektród: platina lemez elektród, ionszelektív elektród, Ag/AgCl kettőssóhidas referencia elektród
A potenciometriás analízisnek két változata van: a közvetlen vagy direkt potenciometria és a potenciometriás titrálás vagy indirekt potenciometria.
Előbbinél a kísérletileg mért elektromotoros erő értékéből a Nernst-egyenlet alapján számítjuk az elektródaktív komponens keresett koncentrációját. Ilyen módon történik technológiai folyamatok folyamatos ellenőrzése valamely gyártásközi termék potenciometriás mérésével.
A közvetlen potenciometriás mérések gyorsan keresztülvihetők, azonban hibájuk viszonylag nagy, hiszen a Nernst-egyenlet értelmében az elektródaktív anyag egy nagyságrendnyi koncentrációváltozása 0,059/n V elektromotoros erő változást okoz, ahol n az elektródreakcióban résztvevő elektronok száma mólonként. A legpontosabb elektromotoros erő mérési hibája is eléri a ± 0,1 mV-ot, ami a koncentrációban láthatóan jelentős hibát okoz.
A potenciometriás titrálás végpontjelzésre is szolgálhat (indirekt potenciometria). Ilyen esetben az indikátorelektród a meghatározandó elektródaktív anyagot tartalmazó oldatba merül, és a titrálás során a mérőoldat fogyás függvényében mérjük az elektromotoros erő változását. Így kísérletileg határozunk meg titrálási görbét, amelynek inflexiós pontja jelzi a végpontot. A mérés pontosságát tehát nem a potenciálmérés pontossága, hanem a végpont megállapításának pontossága határozza meg. Így ennek az eljárásnak kisebb lesz a hibája.
A gyakorlatvezető útmutatásai alapján végezze el a pH-mérő kalibrálását, majd határozza meg a kiadott mintaoldatok pH-ját.
Anyagok: kalibráló pufferek, HCl ismeretlen, NaOH ismeretlen, desztillált víz, csapvíz, üdítőital, cola
Eszközök: főzőpohár, CONSORT pH-mérő, kombinált üvegelektród
A gyakorlat menete: Az ismeretlent tartalmazó 100,00 cm3-es mérőlombikot (számát írja fel) desztillált vízzel töltse jelig. Az így kapott oldatból hasas pipettával 20,00 cm3-t mérjen ki egy száraz főzőpohárba. Kapcsolja be a pH-mérőt és helyezze az alaposan megtisztított elektródot az ismeretlent tartalmazó oldatba. Jegyezze fel az értékek állandósulása után a pH-t (elektromotoros erőt). Ismételje meg a mérést még kétszer, közben gondosan öblítse le és törölje le az elektródot.
Beadandó: Adja meg a mért oldatok pH-ját! Számítsa ki az ismeretlen HCl és NaOH oldat koncentrációját mg/100 cm3 egységekben kifejezve.
Anyagok: mérőoldat: 0,1 M faktorozott HCl-oldat (faktora feljegyzendő!) (indikátorok: fenolftalein, metilvörös)
Eszközök : büretta, pipetta, főzőpohár, CONSORT pH-mérő, kombinált üvegelektród, mágneses keverő
A gyakorlat menete: Az ismeretlent tartalmazó 100,00 cm3-es mérőlombikot (számát írja fel) desztillált vízzel töltse jelig. Az így kapott oldatból hasas pipettával 10,00 cm3-t mérjen ki egy száraz főzőpohárba és az oldatot egészítse ki d.vízzel kb. 75,00 cm3-re. Mágneses keverőt használunk, ekkor ügyeljen arra, hogy a főzőpohárban lévő mágnes és az oldatba merülő elektród ne érintkezzen! Kapcsolja be a pH-mérőt és helyezze az alaposan megtisztított elektródot az ismeretlent tartalmazó oldatba. Töltse fel a bürettát faktorozott 0,1 M HCl-oldattal. Az első titrálás során 1,00 cm3-ként adagolja a 20,00 cm3 HCl mérőoldatot, először fenolftalein jelenlétében, majd metilvörös alkalmazása mellett. Jegyezze fel az egyes mérőoldat-mennyiségek adagolása után a pH-t. A titrálást még legalább 2-szer ismételje meg úgy, hogy az átcsapási tartomány környékén kisebb (0,20 cm3) részletekben adagolja a mérőoldatot.
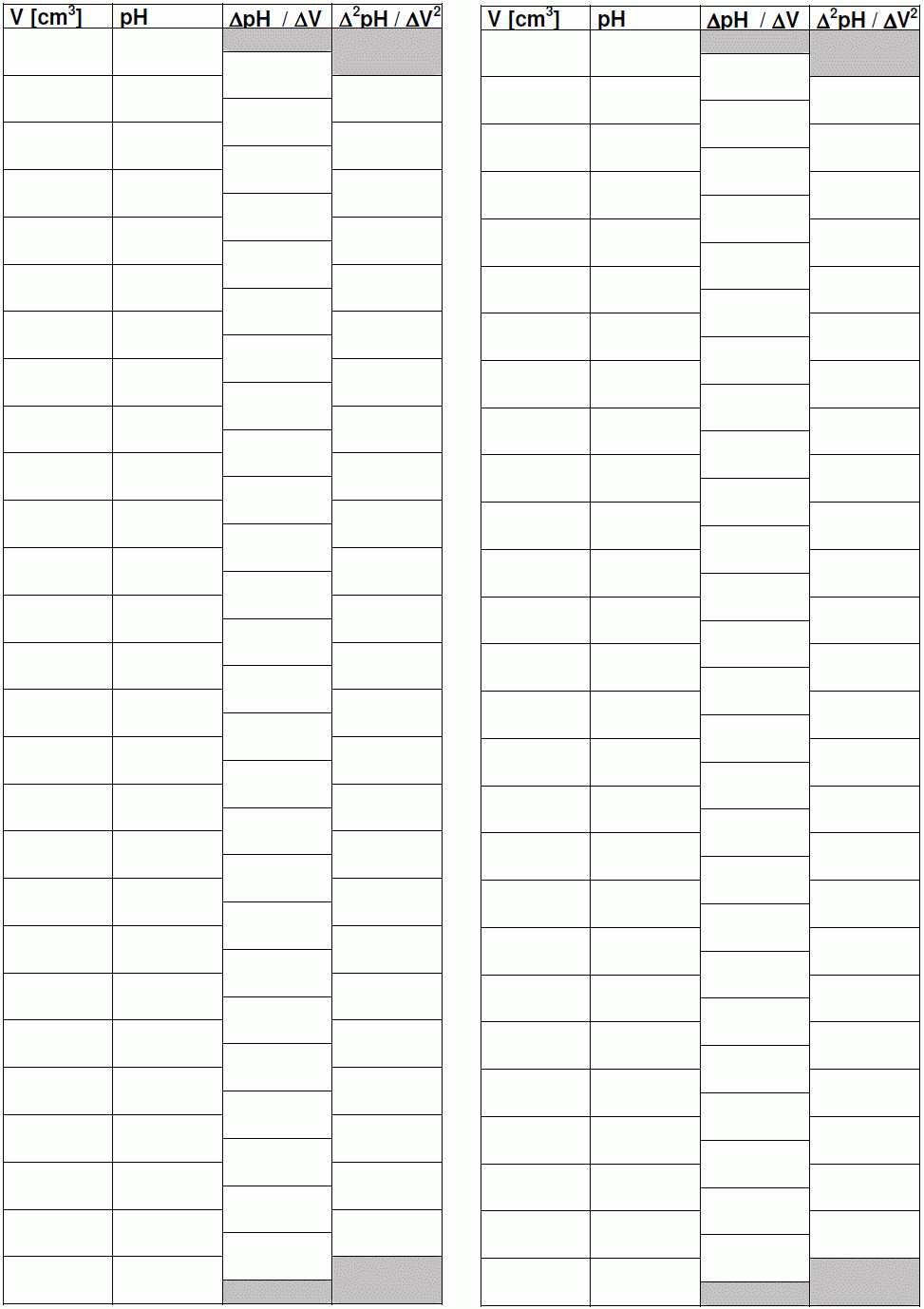
Beadandó: Ábrázolja milliméterpapíron a mért pH-értékeket, a ΔpH-t, és a Δ2pH-t a fogyott mérőoldat térfogatának függvényében! Határozza meg az ekvivalencia pontokat grafikus úton és a "hasonló háromszögek" módszerének használatával. Az ekvivalenciapontban különböző módokon meghatározott értéket átlagolja, majd számítsa ki az ismeretlen oldat koncentrációját mg/100 cm3 egységekben kifejezve, adja meg az átlagérték szórását! Hasonlítsa össze a különböző indikátorok mellett mért átcsapási pontokat a számított egyenértékpontokkal!
Anyagok: mérőoldat: 0,1 M faktorozott HCl-oldat (faktora feljegyzendő!), indikátorok: fenolftalein, metilvörös
Eszközök : büretta, pipetta, főzőpohár, CONSORT pH-mérő, kombinált üvegelektród, mágneses keverő
A gyakorlat menete: A karbonáttal szennyezett NaOH mintát jelre töltjük és 10,00 cm3-t kimérünk egy száraz főzőpohárba. Az oldatot egészítsük ki desztillált vízzel kb. 75,00 cm3-re. Mágneses keverőt használunk, ekkor ügyeljen arra, hogy a főzőpohárban lévő mágnes és az oldatba merülő elektród ne érintkezzen! Kapcsolja be a pH-mérőt és helyezze az alaposan megtisztított elektródot az ismeretlent tartalmazó oldatba, adjon hozzá 2-3 csepp fenolftalein oldatot. Töltse fel bürettát faktorozott 0,1 M HCl-oldattal. A titrálás során 1,00 cm3-ként adagoljuk a HCl mérőoldatot, amíg a leolvasott pH érték 11,50 alá nem csökken. Ezt követően a 2,5 pH érték eléréséig 0,20 cm3 részletekben adagolja a mérőoldatot, majd a mérést folytassuk 20 cm3 mérőoldatfogyás eléréséig 1,00 cm3-es adagolással. A fenolftalein elszíntelenedése után adjon hozzá metilvörös indikátor, jegyezze fel az indikátorok színváltozása milyen pH-nál történt. A folyamat során lejátszódó reakciók egyenletei az alábbiak:
(1) NaOH + HCl = NaCl + H2O
(2) Na2CO3 + HCl = NaHCO3 + NaCl
(3) NaHCO3 + HCl = NaCl + H2O + CO2
Látható, hogy a Na2CO3megtitrálásához kétszeres mennyiségű HCl szükséges. Az első ekvivalenciapontig az (1)+(2) egyenleknek megfelelő fogyást mérjhető ('A' fogyás), míg második ekvivalencipont a (3)-ra jellemző értéket ad ('B' fogyás). Ebből következik, hogy a két egyenértékpont különbségének a kétszerese (2x('B'-'A'))fogja meghatározni a minta Na2CO3 koncentrációját, míg a NaOH koncentrációja az 'A'-2x'B' összefüggéssel számítható ki.
Beadandó: Adja meg az indikátorok átcsapásához tartozó pH értékeket, magyarázza meg, melyik színváltozás, melyik egyenértékponthoz tartozik. Ábrázolja milliméterpapíron a mért pH-értékeket, a ΔpH-t, és a Δ2pH-t a fogyott mérőoldat térfogatának függvényében! Határozza meg az ekvivalenciapontokat grafikus úton és a hasonló háromszögek módszerének használatával. Az ekvivalenciapontban meghatározott mérőoldat fogyásokból számítsa ki a minta NaOH és Na2CO3 koncentrációját mg/100 cm3 egységekben kifejezve, valamint adja meg a Na2CO3 tartalmat tömegszázalékban (m/m%) is!
Anyagok: Mérőoldat: 0,1 M faktorozott NaOH-oldat (faktora feljegyzendő!)
Eszközök : büretta, pipetta, főzőpohár, CONSORT pH-mérő, kombinált üvegelektród, mágneses keverő
A gyakorlat menete: Az ismeretlent tartalmazó 100,00 cm3-es mérőlombikot (számát felírjuk) desztillált vízzel jelig töltjük. Az így kapott oldatból hasas pipettával 10,00 cm3-t kimérünk egy száraz főzőpohárba és az oldatot egészítsük ki d.vízzel kb. 75 cm3-re. Mágneses keverőt használunk, ekkor ügyeljünk arra, hogy a főzőpohárban lévő mágnes és az oldatba merülő elektród ne érintkezzen! Kapcsoljuk be a pH-mérőt és helyezzük az alaposan megtisztított elektródot az ismeretlent tartalmazó oldatba. Töltsük fel bürettát faktorozott 0,1 M NaOH-oldattal. Az első titrálás során 1,00 cm3-ként adagoljuk a NaOH mérőoldatot. Jegyezzük fel az egyes mérőoldat-mennyiségek adagolása után a pH-t (elektromotoros erőt). A titrálást még legalább 2-szer ismételjük meg úgy, hogy az átcsapási tartomány környékén kisebb (0,20 cm3) részletekben adagoljuk a mérőoldatot. Ábrázoljuk milliméterpapíron a mért pH értékeket, ΔpH-t, és a Δ2pH-t a fogyott mérőoldat térfogatának függvényében! Olvassuk le a görbékről a titrálás ekvivalenciapontjait, majd ezek átlagértékéből határozzuk meg az ismeretlen oldat koncentrációját.
Beadandó: Ábrázoljuk milliméterpapíron a mért pH-értékeket, a ΔpH-t, és a Δ2pH-t a fogyott mérőoldat térfogatának függvényében! Határozzuk meg az első ekvivalenciapontot grafikus úton és a "hasonló háromszögek" módszerének használatával. Az ekvivalenciapontban meghatározott értékek átlagolásával határozzuk meg az ismeretlen oldat koncentrációját mg/100 cm3 egységekben kifejezve, adjuk meg az értékek szórását!
Anyagok: Mérőoldat: 0,05 N faktorozott Ce(SO4)2-oldat (faktora feljegyzendő!)
Eszközök : büretta, pipetta, főzőpohár, multiméter, platina elektród, Ag/AgCl elektród, mágneses keverő
A gyakorlat menete: Az ismeretlent tartalmazó 100,00 cm3-es mérőlombikot (számát felírjuk) desztillált vízzel jelig töltjük. Az így kapott oldatból hasas pipettával 10,00 cm3-t kimérünk egy száraz főzőpohárba és az oldatot egészítsük ki 5%-os H2SO4-oldattal kb. 75,00 cm3-re. Mágneses keverőt használunk, ekkor ügyeljünk arra, hogy a főzőpohárban lévő mágnes és az oldatba merülő elektródok ne érintkezzenek! Kapcsoljuk be a feszültségmérőt és helyezzük az elektródokat az ismeretlent tartalmazó oldatba. Töltsük fel a bürettát faktorozott Ce(SO4)2 mérőoldattal. Az első titrálás során 1,00 cm3-ként adagoljuk a mérőoldatot. Jegyezzük fel az egyes mérőoldatmennyiségek adagolása után mért feszültségeket. A titrálást még legalább 2-szer ismételjük meg úgy, hogy az átcsapási tartomány környékén kisebb (0,20 cm3) részletekben adagoljuk a mérőoldatot.
Beadandó: Írjuk fel és rendezzük a reakcióegyenletet. Ábrázoljuk milliméterpapíron a mért feszültséget, a feszültség különbségeket (első derivált), és a második deriváltakat a fogyott mérőoldat térfogatának függvényében! Olvassuk le a görbékről a titrálás ekvivalenciapontjait és a hasonló háromszögek módszerével is határozzuk meg ezeket, majd ezek átlagértékéből számítsuk ki az ismeretlen oldat koncentrációját. Adjuk meg a koncentrációt továbbá a szórást mg/100 cm3 egységekben kifejezve.
A jegyzőkönyvnek tartalmaznia kell:
a gyakorlat rövid leírását
a mért értékeket táblázatosan (táblázat a gyakorlat leírásának végén)
a titrálási görbéket
a derivált titrálási görbéket
a számolás menetét
az ismeretlen koncentrációját (mg/100 cm3)
direkt és indirekt potenciometria, galváncella, indikátor elektród, viszonyító elektród, sóhíd, diffúziós potenciál, elektródaktív anyag
Hasonlítsa össze a direkt és indirekt potenciometriás mérési módszereket!
Jellemezze a referenciaelektródok felépítését és működését!
Redoxi titrálást végez potenciometriás végpontjelzéssel. Milyen eszközöket szükségesek, mi a szerepük?
Rajzoljon pH meghatározásra alkalmas elrendezést kombinált üvegelektróddal. Magyarázza meg röviden (!) a működését!
Írja fel a Nernst-egyenletet! Adja meg a jelölések jelentését!
Jellemezze a másodfajú fémelektródokat!
Milyen összefüggést ismer az oldott anyag aktivitása és az elektródpotenciál között?