A feltevéseket szépen alátámasztja, hogy a hatalmas termetű Dissostichus mawsoni (7. ábra) olyan gént tartalmaz, amely tökéletes átmenetet képez a tripszinogén-gén és a modern AGFP-gén között, azaz ThrAlaAla motívumból már nagyszámút tartalmaz, és még a további exonok is megvannak benne.
Génduplikáció és géncsaládok
Új gének keletkezésének leggyakoribb módja a génduplikáció. Ilyenkor új gének kialakulásának kiindulási pontja a már előzőleg meglévő gének másolatainak megjelenése. Sok gén nagyobb géncsoportok tagja, amelyeket géncsaládoknak nevezünk, és egyértelmű közös őssel rendelkeznek. Ezen géneknek gyakorta eltérő, de rokonítható a funkciójuk. A duplikált gének két típusra oszthatók: variáns és invariáns ismétlődésekre. Az invariáns ismétlődések (közel) azonos szekvenciájúak. Sok esetben az invariáns ismétlődések kimutathatóan több, a normális funkcióhoz egyébként szükséges génterméket eredményeznek (elnevezés:”dosage repetition”). Jellegzetes példák a transzlációhoz szükséges tRNS- és rRNS-gének. Másik szép példa egy kaliforniai Culex szúnyog észteráz génje, amelynek amplifikációja (megtöbbszöröződése) inszekticid (rovarölő) rezisztenciához vezetett, és a Drosophila melanogaster metallothionein génjének duplikációja, aminek a nehézfém-rezisztencia detoxifikációban van szerepe.
A variáns génpéldányok szekvenciája különböző mértékben különbözhet. Különbözőségük mértékétől függően alkothatnak multigén családokat (multigene families), enyhén, vagy közepes mértékben különböző génekkel és szupercsaládokat (látványosan különböző tagokkal).
A multigén családokba tartoznak például a különböző izozimek, amelyek különbözhetnek bizonyos mértékig a funkcióban, vagy szabályozásban, így hozzájárulhatnak az élőlény fiziológiai folyamatainak finomszabályozásához.
A szupercsaládok génjei ezzel szemben már hosszú idővel ezelőtt divergálódtak, és egészen eltérő funkciójuk is lehet. Szép példa a tripszin és a kimotripszin esete, amelyek legalább egymilliárd éve különültek el. Ez a két emésztőenzim különböző funkciókra tett szert: a tripszin az arginin és lizin aminosavaknál vágja el a polipeptidláncot, míg a kimotripszin célpontja a fenilalanin, triptofán és tirozin.
A redundáns duplikált géneknek csak minimális esélyük van új génné alakulásra. Sokkal nagyobb a valószínűsége annak, hogy káros mutációk akkumulálódnak bennük, és funkcióképtelenné válnak: alapvető szabályszerűség, hogy sokkal gyakoribbak a káros, mint az előnyös mutációk ezekben a génekben is. A folyamat végeredménye a funkcióval nem rendelkező pszeudogén. A legtöbb multigén család és szupercsalád nagy százalékban tartalmaz pszeudogéneket.
A globin-géncsalád például hem-kötő fehérjéket kódolnak és oxigént kötnek. Emlősöknél az ε-, ζ-, és a γ-globin láncoknak magasabb az oxigén-affinitása, és embrionális szövetekben fejeződik ki, míg az α-, és β-láncok a kifejlett egyedekben funkcionálnak. A génduplikáció molekuláris mechanizmusai máig nem teljes körűen ismertek, de bizonyos, hogy (1) DNS-szinten történik, mivel a duplikátum és az eredeti példányhoz hasonló struktúrában tartalmazza az intronokat és exonokat, valamint (2) az egyenlőtlen (unequal) crossing over közismerten változtatja a géncsaládok példányszámát.
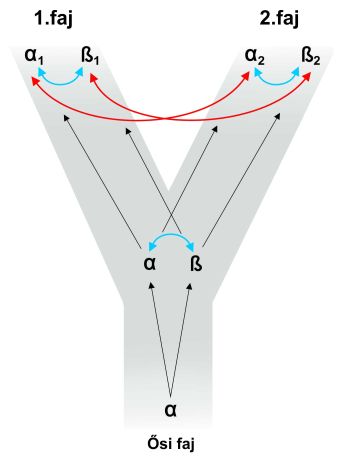
A géncsalád tagjai közötti származási viszonyok elemezhetők filogenetikailag a fajon belül és a fajok között egyaránt. Ez a kétféle viszony a gének között a homológia kétféle formáját is jelenti: az ortológiát és a paralógiát (8. ábra). Ortológ gének találhatók a különböző fajokban, egy közös ős génből erednek, és a filogenetikus hasadás következtében távolodtak el egymástól A géncsaládok egy fajban lévő tagjai a paralógok, egy közös ős génből erednek, egy genom részét képezik génduplikációval.
3.7. ábra - Ortológia és paralógia (a piros nyilakkal jelzett génpárok ortológok, a kékkel összekapcsoltak paralógok)
 |
Nagy duplikációk (paralóg régiók) gyakran tartalmaznak több száz gént. Az emberi 6. kromoszóma MHC (major histocompatibility complex) lókusza nagyszámú patogén-rezisztencia génje között beékelődve sok háztartási gén van. Hasonló génkészletek, ugyanebben a génsorrendben, megtalálhatók az 1., 9., és 19. kromoszómán. A háztartási gének hasonló paralóg régiói megvannak a gerinctelenekben is. MHC-régiók csak az állkapcsos gerincesekben vannak jelen, de azok a kromoszómális régiók, amelyekbe beágyazódtak, úgy tűnik, nagyon ősi eredetűek.
A géncsaládok mérete nagyon változatos, az immunoglobulin szupercsalád 800, míg az emberi riboszomális RNS gének családja 1000 tagú. A géncsaládok mérete sokszor specifikus adaptációkat tükröz: az emlősöknek például több száz szaglási receptort kódoló génje van, minden egyes receptor fehérje egy, vagy legfeljebb néhány illékony szaganyagra érzékeny.
A géncsaládok filogenetikai és adaptív diverzifikációja
A duplikált gének sorsa többféleképpen alakulhat. Számos módon divergálódhatnak szekvenciaszinten, amivel általában funkcióváltozással is jár. Másik lehetőség, hogy egyik példány funkcióképes marad, míg a másik funkcióképtelen pszeudogénné válik. Lehetséges az is, hogy egy gén deletálódik, azaz „kiesik”.A gének tehát „születhetnek” és „meghalhatnak”, ami a géncsaládok tagjainak erőteljes dinamikájához vezet.
Génkonverzió
Génkonverzió akkor történik, ha az egyik lókuszról egyirányúan adódik át szekvenciainformáció a géncsalád többi tagjának, ami oda vezet, hogy legtöbb, vagy minden tag ugyanazt a szekvenciát hordozza. A génkonverzió molekuláris mechanizmusa nem ismert nagy mélységben, de végeredménye, a géncsalád tagjainak közös evolúciója (concerted evolution) jól ismert. Ugyanazon géntermék termelődhet sok ugyanolyan génpéldányról, ami lehet adaptív, ha a géntermékből nagy mennyiségekre van szükség. Biztosan káros lenne, ha pl. az azonos rRNS-gének sok példányának rRNS transzkriptumai más-más szekvenciájúak lennének.
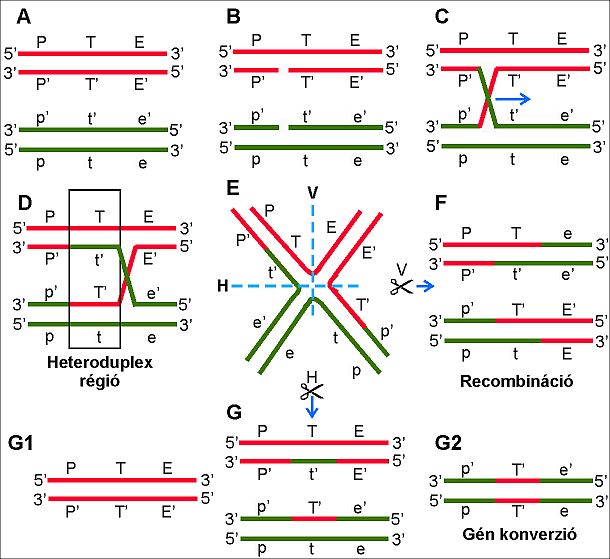
A kromoszómák közötti rekombináció, illetve gén konverzió molekuláris magyarázatára Robin Holliday 1964-ben tette közzé az un. „crossing over” modelljét. Az eredeti modell szerint a homológ kromoszómák azonos polirítású szálain egy-egy hasítás előzi meg a DNS szálak keresztezését. Az így kialakult „Holliday struktúra” szabadon mozog és adott esetben az eltérő alléleket kódoló DNS szálak kölcsönösen átkerülnek az egyik homológ kromoszómáról a másikra. A crossing over által érintett kromoszómális régiók további sorsa részben függ a Holliday struktúra feloldását végző enzim hasítási irányától, illetve az esetleges mismatch hibák javítására választott templáttól. Ennek megfelelően a hasítási végtermék lehet egy rekombinálódott kromoszóma pár, avagy két olyan kromoszóma, aminek bizonyos lókuszain heteroduplex képződés történt. A heteroduplex régiók mismatch hibáinak javításához szolgálhat templátul az eredeti DNS szál és ilyen módon a homológ kromoszómák közötti átmeneti információ (allél) cserének a továbbiakban nem marad nyoma. Azonban, amennyiben a hibák javítása nem az eredeti szál alapján történik, akkor a „betolakodó” DNS szál által képviselt allél kerül örökítésre. Ma már újabb modellek az elfogadottak, de közös elemük a heteroduplex képződés, és a génkonverzió létrejöttének lehetősége, annak viszonylagos magas, megfelelő tesztrendszerrel kísérletesen is vizsgálható és kimutatható aránya (9.ábra).
A duplikált gének átmehetnek génkonverzión.
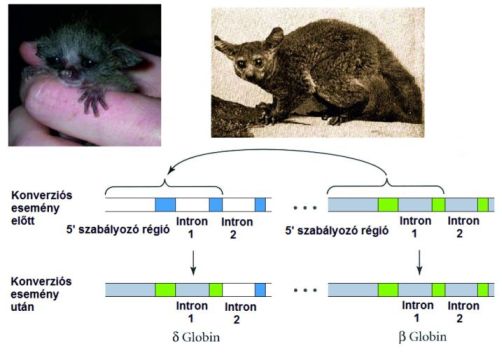
Sok állatfaj globin géncsaládjának vizsgálata bizonyította, hogy gyakori ennek a géncsaládnak az együttes evolúciója, és gyakori a génkonverzió, néha nyomon követhető hatással a génkifejezdési mintázatokra.
Sok főemlős δ-globin génje általában alacsony szinten fejeződik ki, míg a β-globin gén magas szinten. A galágóknál, amelyek az afrikai főemlősök bazális ágát képezik és a madagaszkári makikkal állnak közelebbi rokonságban, a δ-globin gének erősen fejeződnek ki. Hogy tisztázzák az adott mintázat kialakulásának alapjait, meghatározták a galágók δ-, és β-globin génjeinek szekvenciáját, majd összevetették őket (1) egymással és (2) humán megfelelőikkel.
Míg emberben a kódoló régiók, a génkifejeződést szabályozó „upstream” szabályozó régiók, és az 1. intron nagyban eltért a két gén között, ugyanezek a szekvenciák megegyezteka két galágó gén esetében. A galágó gének igen alapos vizsgálata megmutatta, hogy a β-gén első harmada tevődött át a δ-gén első harmadára. A 2.intron nemkódoló szakaszának különbségeire alapozva aztán arra a következtetésre jutottak, hogy a konverziós esemény 18-24 millió évvel ezelőtt történt, sokkal azután, hogy az emberek és galágók közös őse élt. Az 5’-szabályozó elemek a galágó mindkét génjénél megegyeztek a már eredetileg magas szinten kifejeződő β-globin génekéivel, ezért fejeződik ki a galágó δ-globin génje is magas szinten (10. ábra).
Génduplikációkat követő filogenetikai mintázatok
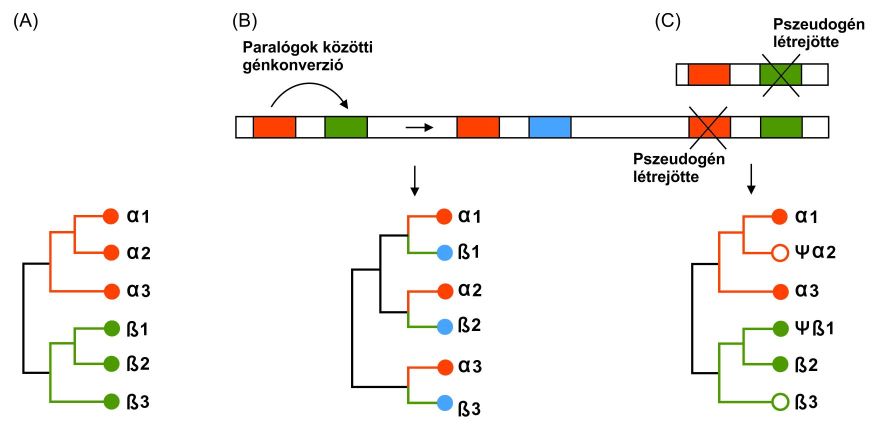
Ha két vagy több faj közös ősében duplikáció történik, a duplikált géneknek különböző további sorsuk lehet, ami különböző filogenetikai mintázatokat eredményezhet (11. ábra):
-
1. Divergens evolúciós modell. Ha a génduplikáció megelőzi a speciációt, és a duplikátumok szekvenciája divergál a fajon belül és a fajok között egyaránt, a létrejött filogenetikai fa fő mintázatai megfelelnek a különböző paralógoknak. Mindegyik paralógnál külön-külön tükröződnek a fajok elválására jellemző mintázatok
-
2. Együttes evolúciós modell. Ha a lókuszok együttes evolúción esnek át, bármelyik ősi fajban is jelennek meg a szünapomorf mutációk, azok minden olyan faj minden paralóg génjében meglesznek, amelyek ugyanattól az ősi fajtól származnak. Abban a fában, amely ilyen szekvenciákon alapul, a faj filogenetikai származását mutatja, a paralógok pedig minden egyes fajon belül jelennek meg, mivel a génkonverzió miatt rendkívül hasonlóak lesznek.
-
3. “Születés és halál” (Birth-and death) modell. Ha néhány paralóg elveszik egy vagy több fajban, vagy nem lehetett őket azonosítani, mert szekvenciájuk annyira eltér, hogy nem lehetett őket paralógként felismerni. Ilyenkor funkcionális- és nem funkcionális gének vegyesen lesznek jelen a filogenetikai fán.
3.10. ábra - A duplikált gének sorsának lehetséges alakulása (A: Divergens evolúciós modell; B: Együttes evolúciós modell; C: “Születés és halál” modell).
Frissen duplikálódott lókuszok szelekció alatt
A paralóg gének kezdetben redundánsak: amikor a génduplikáció bekövetkezik, ugyanannak a génnek két példánya lesz jelen a genomban, ezzel megnyílik a funkcionális elválás lehetősége, ami alapvetően két modell alapján játszódhet le.
Neofunkcionalizáció: Susumo Ohno (1970) fogalmazta meg a neofunkcionalizáció klasszikus modelljét: a duplikált gének egyik példánya eszerint megtartja eredeti funkcióját, míg a másik példány új funkcióra tesz szert, új mutációk fixációjának köszönhetően. Ennek a folyamatnak a léte mellett szól, ha egy újonnan duplikálódott génnek csak egyik példányában halmozódnak fel más aminosavat kódoló (nemszinoním) szubsztitúciók. Neofunkcionalizáció nyilvánvalóan csak akkor lép fel, ha az előnyös új mutáció azelőtt történik, hogy a duplikátum elveszítené funkcióját az azt "elrontó" mutációk fixálódása miatt, azaz mielőtt pszeudogénné vált volna.
A főemlősök ribonukleáz géncsaládjának két tagja, az eosinophil cationic protein (ECP) gén, és a eosinophil-derived neurotoxin (EDN) gén szolgál példaként az elméletre. Kimutatták, hogy az ECP génben nagyszámú nemszinoním duplikáció jelent meg, miután megjelent az EDN gén duplikátumaként. Ezenfelül az ECP géntermékének patogénellenes funkciója is van, ami újdonság, és arra utal, hogy a funkcionális diverzitás a duplikációs esemény után jött létre, aminósav szubsztitúciók gyors felhalmozódásával.
Szubfunkcionalizáció: a XX. század legvégén az adaptív divergenciának egy újabb lehetőségét vetették fel, a szubfunkcionalizációt: ilyenkor mindegyik génduplikátum specializálódik az ősi, egy példányban jelenlévő gén egy szubfunkciójára szakosodik. Ennek a modellnek a neve DDC (duplication-degeneration-complementation). A hipotézis szerint az ősi génnek két, vagy több funkciója volt, és előadódhat, hogy mindkét paralógnak más-más funkciója érintett, azaz a két paralógban komplementer mutációk fixálódnak, amelyek más-más funkciót redukálnak vagy eliminálnak. A paralógok így már nem redundánsak, tehát a természetes szelekció megtarthatja mindkettőt, a későbbiekben pedig további evolúciós változásokon és funkcionális specializáción eshetnek át. A DCC modell tehát különbözik a klasszikus modelltől: itt mindkét duplikált génpéldány szekvenciája és funkciója megváltozik az ősi génhez viszonyítva. A modell megjósolja továbbá, hogy a duplikált gének kisebb valószínűséggel vesznek el. A poliploid növényekben a duplikátumok több mint 15%-a marad funkcióképes, ami messze meghaladja a klasszikus modell által előrevetített értéket.
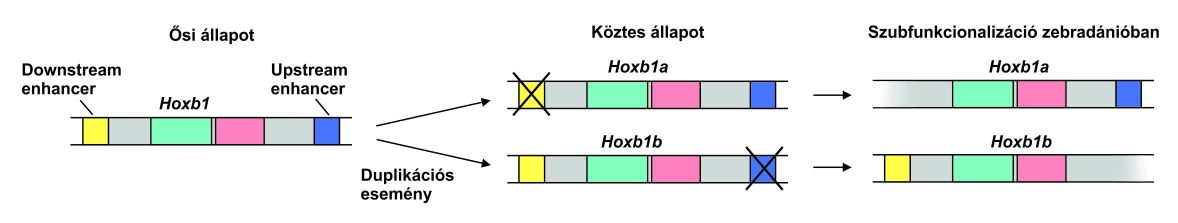
A Hoxb1 génből a gerinceseknél általában egy példány van jelen, míg a zebradánióban (hal) duplikáció történt: a két duplikált példány a Hoxb1a és a Hoxb1b. Míg az egér Hoxb1 génje folyamatosan fejeződik ki a fejlődő nyúltagyban, a zebra dánióban a Hox1a és Hox1b egymást követően fejeződik ki: a Hox1a kifejeződése befejeződik 10 órával a megtermékenyítés után, míg a továbbiakban a Hox1b veszi át a helyét. A molekuláris analízis kimutatta, hogy a Hox1a egy „upstream”, azaz 5’ irányban lévő szabályozó elemet (enhancert), míg a Hox1b egy „downstream”, azaz a géntől 3’ irányban lévő elemet veszített el az ősi, más gerincesekben, így az egérben meglevő génformához képest. Az egymást kiegészítő (komplementer) kifejeződési mintázatok, és a hátterükben álló komplementer degenerált mutációk szép példát adnak a szubfunkcionalizációra. (12.ábra)
3.11. ábra - Szubfunkcionalizáció zebradánióban. Az átírás az upstream enhancertől (kék) a downstream enhancer (sárga) irányába zajlik.
 |
A génduplikáció üteme
A géncsaládok nagy változatossága arra utal, hogy a génduplikáció gyakori és általános folyamat. A kétezres évek elején rendelkezésre álló genomszekvenálási adatokat figyelembevéve Lynch és munkacsoportja (2000) arra a következtetésre jutott, hogy a 0,01 duplikáció/ gén/ millió év irányadó lehet. Ez az érték sokkal magasabb, mint korábban gondolták. Az élesztőn végzett analízis (Gao és Innan, 2004.) a génkonverzió magas szintjére utal a duplikált paralógok körében, ami a közöttük való nagyobb hasonlósághoz, és koruk alulbecsléséhez vezet, így arra következtettek, hogy élesztőben a génduplikáció ritkább esemény.
A pontos részletektől eltekintve, és figyelembe véve, hogy az újonnan duplikálódott gének nagy többsége degenerálódik, és nem járul hozzá a funkcionális genomhoz, a duplikált gének adaptív divergenciája nyilvánvalóan elsődleges módja a gének funkcionális változatosságának kialakulásának, és a molekuláris szintű adaptív diverzifikációnak. A génduplikációk tanulmányozása megmutatja az összehasonlító genomika óriási erejét és hogy hogyan szolgálhatják a legkülönbözőbb forrásokból származó adatok a genomevolúcióról alkotott képünk finomítását.
Transzpozíció és új gének születése
Az új transzpozíciós esemény (TE) hatása a hordozó egyedre nagyban attól függ, hol történik. Gyakori, hogy a transzpozábilis elem új kópiáinak inszerciója elhanyagolható hatással van a gazda-élőlény fitnesszére, de ismertek olyan példák is, hogy az inszertálódott elem káros, mert befolyásolja annak a génnek a kifejeződését, amelybe, vagy amelynek közelébe beépült. A TE-k gyakorta jelennek meg a gének közötti régiókban, vagy intronokban, a kódoló régiókban káros mutációkat okoznak, így a tisztító szelekció az ilyen inszerciókat eliminálja.
A transzpozíciónak legalább kétféle genetikai hatása lehet: (1) mutációkat okoznak. Egérben például az ismert spontán mutációk kb.10 százaléka retroelem transzpozícióra vezethető vissza, sokuknál a kódoló vagy szabályozó régió érintett. (2) A transzpozábilis genetikai elemek ismétlődő elemei az illegitim rekombináció alapjául szolgálhatnak. Illegitim rekombináció révén kromoszóma- vagy génátrendeződések jöhetnek létre, gyakorta deléciókkal. Az emberi genetikai rendellenességek megközelítőleg 0,3 százaléka, különös tekintettel a leukémiás megbetegedésekre transzpozíció eredménye. A gazda fitnesszének a káros mutációk miatt való csökkenését gondolják a TE-k mértéktelen felszaporodását gátló legfontosabb tényezőnek.
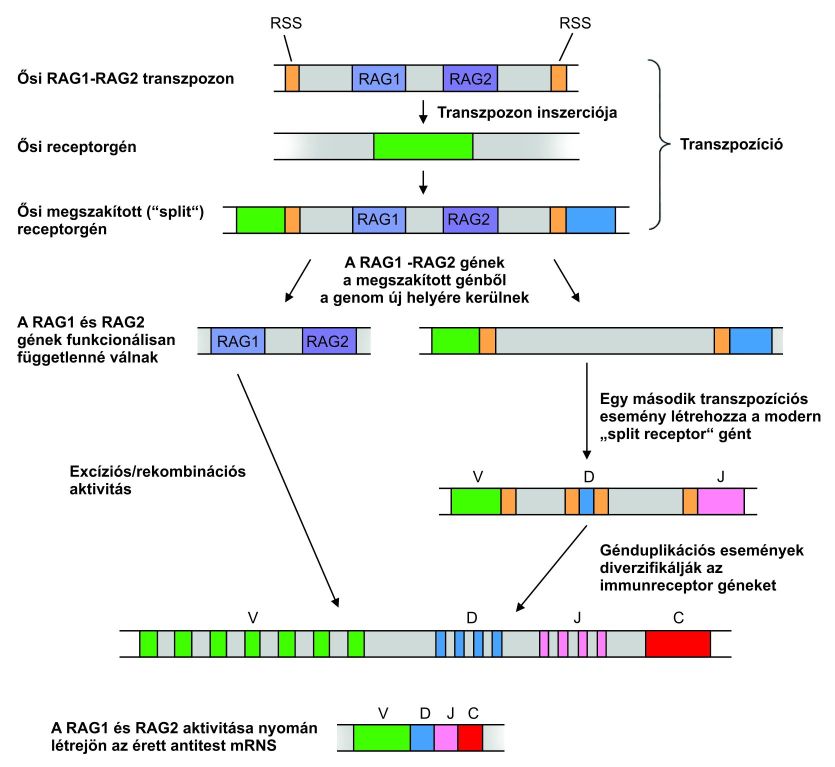
A transzpozíció adaptív evolúcióhoz is vezethet, aminek talán legdrámaibb példája a gerincesek immunrendszerének kialakulásával kapcsolatos. A hatalmas számú immunfehérje mindegyike egy-egy, három szekvenciából (V, D, J) álló összetett gén terméke. A V, D és J szekvenciák a genomban elkülönülten helyezkednek el, de az immunválasz idején a V-D-J rekombinációként ismert folyamat összeilleszti őket. Minden egyes V, D és J szakaszt egy-egy 12 és 23 bázispárnyi rekombinációs szignálszekvencia (RSS) határolja, amely a különböző elemek egy, funkcionálisgénné való pontos összeillesztését teszi lehetővé. A V-D-J illesztésért felelős RAG1 és RAG2 fehérjéket kódoló gének elemzése kimutatta, hogy nincsenek bennük intronok, ami jellemző sajátsága az olyan géneknek, amelyek egy mRNS retrotranszpozíciójával jöttek létre. Az események eredményeként létrejött rövid terminális ismétlődéseket (short terminal duplications) tartalmaztak, amely a tipikus retrotranszpozonok LTR (long terminal repeat) szekvenciájára hasonlítottak. A kutatók következtetése az volt, hogy a gerinces immunrendszer kialakulásának kezdeteinél talán egy TE beépülése áll, amely tartalmazta a RAG1 és RAG2 gének őseit. Ez a TE aztán több áthelyeződéssel feldarabolt egy ősi, immunoglobulinszerű gént, a V, D és J szekvenciák őseire, amelyek mindegyikét terminális ismétlődések határolták. A terminális ismétlődések aztán rekombinációs szignálszekvenciákká alakultak evolúciójuk során, és a különböző szakaszok aztán duplikációs folyamatokkal megsokszorozódtak. Az ilyen „szerencsés” transzpozíción múlt talán az immunrendszer kialakulása, ami aztán új élettereket nyitott meg a gerincesek előtt, lehetővé téve az új paraziták leküzdését (13. ábra) (Agrawal és mtsi, 1998).
3.12. ábra - Transzpozíció szerepe a modern immunreceptor-gének kialakulásában (részletek a szövegben)
 |
Lynch és Conery (2003) kimutatta, hogy a genomok számos olyan tulajdonsága, amelynek nincsen pozitív hatása a fitnesszre, úgy mint az intronok és transzpozábilis elemek jelenléte, valamint a nemkódoló DNS nagy mennyisége kifejezettebb a kis effektív populációmérettel jellemezhető fajokban. A baktériumok és vírusok hatalmas populációkkal rendelkeznek, amelyek megkönnyítik a genom „áramvonalasítását” elősegítő mutációk elterjedését. Ezzel szemben, az eukarióták kisebb populációmérettel rendelkeznek, ami megkönnyíti a nem adaptív jellegek fixálódását.