A kimondottan az emberhez vezető ágon adaptív evolúciót mutató gének különösen érdekesek, mert lehetséges, hogy közük van az embert a többi főemlőstől megkülönböztető, speciális emberi sajátságok kialakulásához.
Két humán gén szerepe fontosnak látszik, adaptív változásuk a csimpánz vonaltól való elválásunk után következett be. A forkhead box 2 (FOXP2) gén mutációi olyan családokból kerültek elő, amelyekben nagy volt a gyakorisága a beszéd-rendellenességeknek, és tagjaik bizonyos nyelvtani szabályokat is nehezen sajátítottak el. A génszekvencia evolúciójának vizsgálata megmutatta, hogy bár csak egyetlen aminósav helyettesítődött az egér és a főemlősök közös ősének elválása óta, két szubsztitúció történt az utóbbi 4-6 millió évben, a csimpánz- és emberi vonal elkülönülésétől számítva, ami az aminósav-szubsztitúciós ráta jelentős felgyorsulását jelenti. Kimutatták azt is, hogy további 28 emlősrendben, amelyeknek közös őse körülbelül 100 millió éve élt, a gén gyakorlatilag nem változott. A FOXP2-gén terméke a jelek szerint egy olyan transzkripciós faktor, amely nagy számú, elsődlegesen az agyban kifejeződő gén kifejeződésére van hatással.
Egy másik, a sarcomeric myosin heavy chain (MYH) gén erőteljesen kifejeződik a csimpánz, és más emberszabásúak rágóizmaiban, és felelős ezeknek az izmoknak a nagy méretéért. Embernél ez a gén egy kereteltolódási (frameshift) mutációval inaktiválódott, számítások szerint 2,4 millió évvel ezelőtt, az után, hogy az ember és a csimpánz vonalak elváltak. A gén mutációja lehet felelős a rágóizmok kisebb méretéért. A funkció elvesztése azzal is járt, hogy az emberi génben mutációk halmozódtak fel. Ez a molekuláris változás hozzájárulhatott az agytérfogat növekedéséhez.
A szaglási ingerek fontos szerepet játszanak az emlősök viselkedésében, de a főemlősök, különösen az ember, sokkal gyengébb szaglással rendelkezik, mint a legtöbb más emlős. A szaglási receptor (olfactory receptor, OR) gének szép példát szolgáltatnak arra a tendenciára, amit – másokat követően - Lamarck és Darwin is megfigyelt, leírt és beépített elméletébe, azaz, hogy a „haszontalan” struktúrák („structures of little use”) hajlamosak a leépülésre. Az egér genomjában körülbelül 1200 funkcionális OR gén van, míg az emberében 550. Az OR gének funkcióját fenntartó szelekciós nyomás mérsékelt emberben, a funkcióra nézve hátrányos mutációk, amelyek pszeudogén képződéshez vezetnek, fixálódhatnak (rögzülhetnek). Hasonló tendencia mutatható ki annál az öt génnél, amely a főemlősök vomeronazális feromonérzékelésre szolgáló szervében fejeződnek ki (Jacobson-szerv az orrmelléküregben). A feromonoknaknak a szociális kölcsönhatásokban van fontos szerepe. A gének két különböző, funkcionális és konzervált családja működik az óvilági majmok számos vonalában, de drámai degenerációjuk figyelhető meg az emberszabásúakban az utóbbi 23 millió évben, mióta elváltak az óvilági majmoktól.
Új gének keletkezése
Az emlősök funkcionális génjeinek száma 30 000 körülire becsülhető. Ez, az egykori becslésekhez viszonyítva kis génszám is nyilvánvalóan egy nagyon kis génszámból alakult ki, visszatekintve a legtávolabbi időkbe, csak néhány génből. A főbb csoportok funkcionális génszáma különbözik. Hogyan alakulhatott ki ez a sokféle gén? Mik lehettek azok a mechanizmusok, amelyek új gének kialakulásához vezettek?
Az evolúcióbiológusok számos olyan mechanizmust írtak le, amelyek alapjául szolgálhattak gének létrejöttéhez egy genomban akár az előzőleg a genomban jelen lévő génekből, akár egy másik fajból származó génekből. A mechanizmusok közé tartozik a laterális géntranszfer, az exon shuffling, gén chimerizmus, retrotranszpozíció, mutívum multiplikáció és génduplikáció.
Laterális géntranszfer
Előfordul, hogy bizonyos gének elemzése merőben más rokonsági viszonyokat sugall, mint az adott genom többi, túlnyomó többségben lévő génjei. Ha különböző gének különböző filogenetikai viszonyokra utalnak, a vonalak közötti laterális géntranszfer (LGT) a valószínű magyarázat. Mára az a kép alakult ki, hogy, különösen az élet történetének korai szakaszában a genetikai anyag nagyon különböző vonalak között is átadódott az élet korai szakaszában, sőt, elterjedt a nézet, hogy az eukarióták Archeák és Bacteriák bizonyos formáinak fúziójával alakultak ki.
A laterális géntranszfer (LGT; másik elnevezése: horizontális géntranszfer) nemcsak évmilliárdokkal ezelőtt zajlott. Az egysejtű Entamoeba histolytica, amelynek legalább 50 millió vérhas megbetegedés köszönhető világszerte, anaerob módon képes élni az emberi vastagbélben és más szövetekben, olyan fermentációs enzimeknek köszönhetően, amelyek a legtöbb eukariótában nincsenek meg. A filogenetikai analízis megmutatta, hogy az E. histolytica fermentációs enzimek génjei laterális géntranszfer útján kerültek át Archeákból. 40-50 körülire tehető azoknak a humán géneknek a száma, amelyeket bakteriális eredetűnek vélnek.
A LGT azonban különösen a prokarióták körébengyakori , új adaptációs mechanizmusok genetikai háttere könnyen terjedhet a kromoszómaként elkülönülő plazmidokon.
Exon shuffling
A laterális géntranszfer új géneket ad egy vonal genomjához, de a gének olyan értelemben nem újak, hogy már léteztek a forrásként szolgáló fajban. Más mechanizmusok „igazi” új géneket hoznak létre, közülük az egyik kiemelkedő fontosságú az exon keverés, összekeverés (shuffling).
Az eukarióta gének általában intronokat és exonokat tartalmaznak. Szoros megfelelés van a gén exonjai és a fehérjék doménjai között. A fehérje domén (vagy „modul”) egy kis, 100 aminosav körüli nagyságú fehérjerészlet, amely specifikus háromdimenziós szerkezetet vesz fel, függetlenül más doménektől. A fehérjedoméneknek gyakorta van specifikus funkciójuk, bár általános, hogy a domén magában nem tudja ellátni tökéletesen a funkcióját, csak a további doménekkel együtt, amelyek felépítik az érett fehérjét.
Több száz fehérjedomén ismert, a legtöbb fehérje ilyen doménok mozaikja, amely legtöbbször jónéhány különböző doménból áll. A különböző kollagén molekulák például akár ötféle domént tartalmazhatnak, mindezeket különböző sorrendekben. Az egyes doméntípusokból nem csak egy példány fordulhat elő.
Sok olyan domén van, amely sok különböző fehérjében fordul elő. Ilyenek például a nukleotid-kötő és a hem-kötő doménok.
A különböző genomok génjeinek összevetése sok példát adott arra, hogy számos fehérje doménszám-növekedéssel (domain accretion) alakult ki, azaz domének adódtak hozzá az ősi gén elejéhez vagy végéhez. Sok kromatinfehérje génje például úgy alakult ki, hogy a DNS-hez kötődő doménok – helikáz/ATP-áz, cinkujj - kapcsolódtak más fehérjékhez, így azokat is képessé téve a DNS-kötésre.
Ha nem is tökéletes, de sokszor jó közelítő megfelelés van az exonok és a fehérjedoménok között. Ez az egybeesés vezetett az exon shuffling hipotézishez, ami azt állítja, hogy a gének változatossága jelentős részben annak köszönhető, hogy új exonkonbinációk jöhettek létre az intronokban történő illegitim(nemhomológ) rekombináció útján. A becslések szerint az eukarióta genom exonjainak 19%-a már létező exonok exon shuffling már létező exonok áthelyeződésével jöttek létre. Az egyik első jól dokumentált példa az exon shufflingra a burgonya (Solanum tuberosum) cytochrome c1 génje. A génnek kilenc exonja van, közülük az első három felelős a fehérje mitokondriumba jutásáért, ahol az funkcionál..A rendelkezésre álló adatbázisok elemzése megmutatta, hogy az első 3 exon nagyon hasonlít egy olyan gén, a glycerinaldehide-3-phosphate dehydrogenase első három exonjára, amely a mitokondriumban aktív kukoricában, Arabidopsisban, és más növényekben. Az újonnan inszertálódott exonokról átíródó fehérjeszakasz tehát egyfajta vezető (leader) peptidként a mitokondriumba irányítják az új fehérjét.
Kiméra gének és processzált pszeudogének
A kiméra gén két- vagy több különböző elődgén részeit tartalmazza. Láthattuk, hogy kiméra gének létrejöhetnek exon shuffling útján is. Ilyenkor az exonokat intronok választják el, amelyek egyben a genetikai kicserélődés helyszínei is.
Kiméra gének keletkezhetnek retrotranszpozícióval is: ilyenkor az érett mRNS reverz transzkripcióval visszaíródik DNS-sé (cDNS-sé), és inszertálódik egy másik génbe. Az eredmény egy új gén, amely részben exonokból és intronokból, részben intronok nélküli, több összeépült exonból áll.
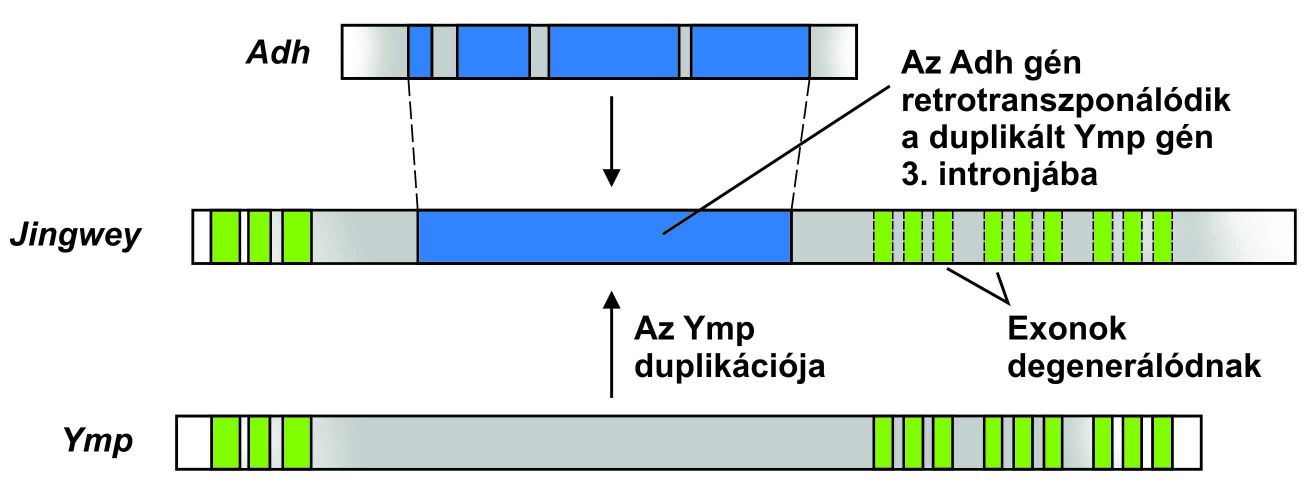
Az első példa a leírtakra a Drosophia teisseri és D. yakuba fajokban meglévő jingwei gén. A jingwei gén négy exonból áll, az első három homológ a Yellow-emperor (Ymp; Sárga Császár) génhez, amely előfordul az említett fajokban, és több más Drosophila fajban. Ez a három exon hosszúságát tekintve tipikusnak mondható, míg a negyedik exon olyan hosszú, mint egy teljes gén. A negyedik exon több, mint 90%-ban hasonló egy jól ismert gén, az alkohol-dehidrogenáz (Adh) szekvenciájához. Az Adh génnek több intronja van, míg a negyedik jingwei exonban nincsenek intronok. Bizonyos, hogy az Adh retrotranszpozícióval átírt példánya inszertálódott az Ymp gén harmadik intronjába a D.teisseri és D. yakuba közös ősébe, létrehozva egy kiméra gént (5. ábra).
Ha nincs is egyértelmű bizonyíték egy hasonló gén létére, amely tartalmaz intronokat, az intronok nélküli gén nagyon valószínű, hogy retrotranszpozícióval keletkezett, ami az intronok elvesztésének legkézenfekvőbb módja. A G-fehérjéhez kötött receptorok (GPCR= G-protein coupled receptors) nagy és változatos családjának tagjai az emlősökben nélkülözik az intronokat, míg a gerinctelenek hasonló génjeiben vannak intronok. Csaknem bizonyos, hogy az emlősök génjei egy ősi gén retrotranszpozíciójával keletkeztek.
Sok retrotranszpozíciós esemény vezet új, de funkcióképtelen gének, úgynevezett „processzált pszeudogének” (processed pseudogenes) keletkezéséhez. Mint ismeretes, pszeudogén minden olyan DNS-szekvencia, amely funkcionális géntől származik; a processzált pszeudogén mRNS retrotranszpozíciójával keletkezett. A DNS szekvencia nagyon hasonlít arra a génre, amelytől származik, de gyakran vannak bennük a leolvasási keretet eltoló deléciók, és nem megfelelő helyzetű stop-kodonok. Az emberi- és más eukarióta genomokban gyakoriak a processzált pszudogének: emberben minimális számukat 8000-re becsülik. Megjegyzendő, hogy a pszeudogének könnyen akkumulálnak mutációkat, mert funkcióképtelenségük miatt nincsen rajtuk szelekciós nyomás, így a felismerhetetlenségig változhatnak.
Motívum többszöröződés és exon-vesztés
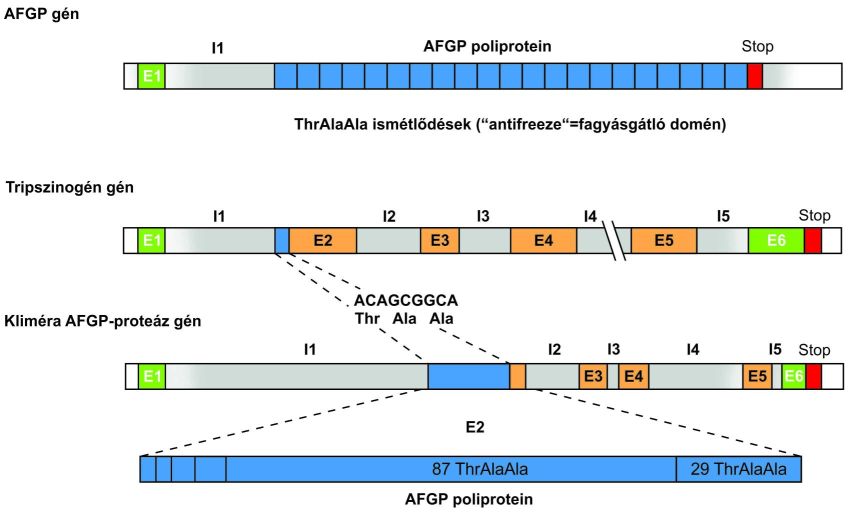
Bizonyos szekvencia-motívumok megtöbbszöröződése a génen belül új géneket és új funkciókat eredményezhet. Az Antarktisz körüli vizek bizonyos halai (Notothenoid) olyan hőmérsékleten tenyésznek, ahol más gerincesek vére megfagyna. Ezekben a halakban fagyálló glikoprotein (AFGP=antifreeze glycoprotein) gének sora evolválódott; rövid polipeptideket kódolnak, amelyek arra szolgálnak, hogy “feltörjék” a jégkristályokat és megakadályozzák a vér megfagyását. Az AFGP-gének olyan polipeptideket kódolnak, amelyek döntő részben a treonin-alanin-alanin= ThrAlaAla három aminosavas egység hetven feletti számú ismétlődéséből állnak. Az AGFP-fehérjék több vonatkozásban hasonlítanak a tripszinogén génjére, amely egyébként teljesen más funkcióval rendelkezik, nevezetesen proteáz.
A tripszinogén-gén első szakasza, egészen a 2. exon elejéig hasonló az AGFP gén első szakaszához. A második exon eleje mondanivalónk szempontjából hangsúlyos: tartalmaz egyetlen ThrAlaAla motívumot a 2. exon elején. További hasonlóság a két gén között, hogy a tripszinogén gén 6. exonja is megvan az AGFP gén 3’ végén, és a két gén 3’-vége is hasonlít.
A közbülső exonokhoz hasonló szakaszok azonban hiányoznak az AGFP-génekből. A szekvenciaadatok tehát amellett szólnak, hogy egy ősi tripszinogén gén második exonjának egy apró motívuma megsokszorozódott („expandált”), és létrehozta az AGFP-gén 2. exonját. A tripszinogén-gén 3.-5. exonja aztán elveszett (6. ábra).
3.5. ábra - Az AFGP poliprotein fagyálló sajátságának származtatása a tripszinogén gén 2. exonjának részletéből (I1-I5 intronok, E1-E5 exonok).
 |