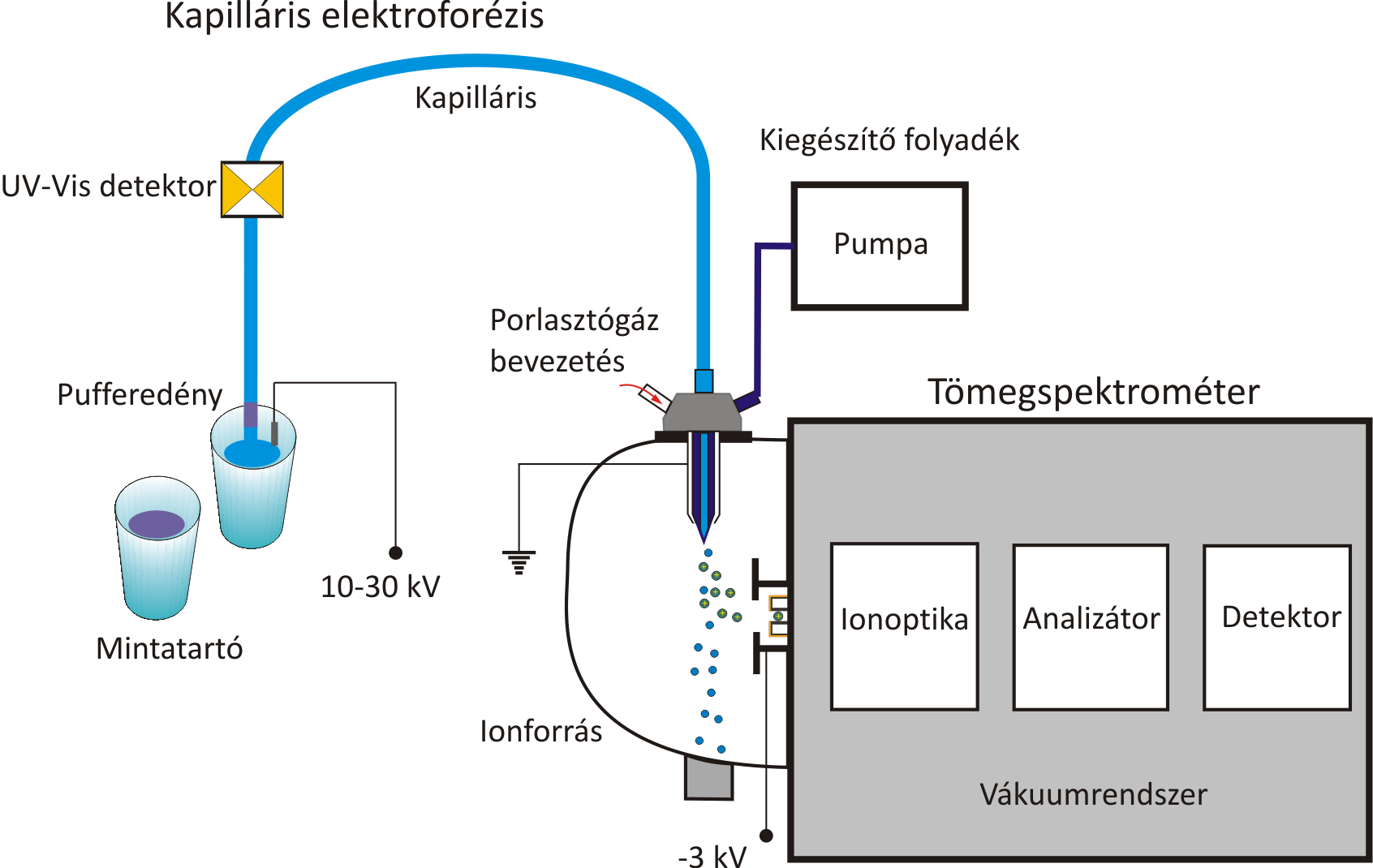
A kapilláris elektroforézis-tömegspektrometria kapcsolás estében az CE előnyeit (gyors elválasztás, kis mintaigény, nagy felbontás, számos mód a szelektivitás fokozására, vizes és nem-vizes közegben egyaránt végrehajtható elválasztások, egyszerű technikai megoldások) fokozhatjuk az MS nyújtotta lehetőségekkel. A CE-MS módszerek a porlasztásos ionizációs technikák kifejlesztésével terjedtek el. A következő problémákat kell áthidalni a két készülék között egy megfelelő illesztőegység alkalmazásával.
A CE elválasztás során 10-30 kV feszültségkülönbség hatására vándorolnak a töltéssel rendelkező részecskék a kapillárisban, míg például az elektrospray ionizáció során csak 2-5 kV szükséges az elektroporlasztáshoz.
Az elektromos kapcsolatot biztosítani kell a CE kapilláris két vége között akkor is, amikor az egyiket az MS ionforrásába „kötjük be”, a pufferedény helyett
A CE kapillárisban nincs vagy csak néhány nl/perc folyadékáram van, ha fellép az elektroendozmozis. A hagyományos ESI porlasztásnál a 5-500 μl/perc az optimális, így egy kiegészítő folyadékáramot kell alkalmazni.
A CE elválasztás során alkalmazott puffer legyen illékony, illetve célszerű olyan vegyületet választani, amely az MS detektálás során nem növeli az ionáramot (pl hangyasav, ecetsav, ammóniumformiát, ammóniumacetát, stb.).
Fokozottan érvényes, hogy össze kell hangolni az elválasztás és a tömeganalízis sebességét. Nagy hatékonyságú, gyors CE módszereket csak gyors pásztázású analizátorral rendelkező MS készülékkel célszerű kombinálni.
Az egyik legelterjedtebb az ún. triaxiális CE-ESI illesztőegység. Ez lényegében három koaxiális kapillárisból áll, melyekben a vizsgálandó oldat, a kiegészítő folyadék, illetve a porlasztó gáz áramlik. Kiegészítő folyadékként ajánlott valamilyen illékony oldószert tartalmazó elegyet (pl. 1% hangyasav, 1:1 metanol:víz) alkalmazni, mely megkönnyíti a porlasztást, ionizációt.
A CE-MS módszerek jelentősége a gyógyszerkutatás, az orvosi és biokémiai alkalmazások területén egyre nő.
A kapilláris elektroforézis elméleti háttere a Kapilláris zónaelektroforézis fejezet, Elméleti bevezető részében, a tömegspektrometria elméleti háttere a Tömegspektrometria fejezetben található.
A gyakorlat során ismeretlen összetételű aminosav keveréket vizsgálunk CE-MS kapcsolt rendszerrel. A tömegspektrometriás analízis előtt a mintakomponenseket előzetesen elválasztjuk kapilláris elekroforézissel és egy illesztőegységen keresztül bejuttatjuk a tömegspektrométerbe.
Készülékek. HP 3DCE System kapilláris elektroforézis berendezés
Agilent 6300 tömegspektrométer elektrospray ionforrással és ioncsapda analizátorral
Mérési paraméterek. CE
Puffer: 50 mM hangyasav, pH=2,5
Kapilláris: leff= 22 cm, Lteljes=76 cm, belső átmérő= 50 μm
Injektálás: 50 mbar . 10 s
Hőmérséklet: 25°C
Feszültség: 25 kV Polaritás: pozitív (a pozitívan töltött mintakomponensek a katód felé vándorolnak)
Detektálás: spektrofotometriás detektálás, λ=200 nm
MS (alapbeállítások)
Kiegészítő folyadék összetétele: 1(v/v)% hangyasav 1:1 metanol:víz elegyben
Kiegészítő folyadék áramlási sebessége: 5 μl/perc
Szárító gáz áramlási sebessége: 4 L/perc
Szárító gáz hőmérséklete: 325°C
Porlasztó gáz nyomása: 15 psi
Detektálás: 50-200 m/z tömegtartományban
Automatikus fragmentálás
Minták. Öt, esszenciális aminosavat tartalmazó minta vízben oldva (öt törzsoldat). Az aminosavak koncentrációja az egyes mintákban 20 mM.
Feladatok:
a készülékek bekapcsolása, üzembe helyezése
a minták mindegyikéből 100 μl-t mérjünk be egy mintatartó edénybe és alaposan keverjük össze Vortex segítségével
a keverék oldat futtatása CE-MS rendszerrel, pozitív ionizációs módban
a mintakomponensek tömegspektrumának felvétele
mintakomponensek [M+H]+ kvázi-molekulaionjainak MS2 analízise
A minták elektroferogramja és az egyes csúcsokhoz tartozó tömegspektrumok
A minták beazonosítása tömegspektrumok (MS és MS/MS) alapján
A minták vándorlási sorrendjének indoklása, magyarázata
Kiértékelés táblázatos formája (aminosav neve és szerkezete, vándorlási ideje, [M+H]+ tömege)
MS2 spektrum, a mintákat jellemző csúcsok azonosítása, a fragmentációs folyamatok értelmezése, fragmensek szerkezeti képlete
elektroferogram, elektroozmotikus áramlás, elektroforetikus mobilitás, kapilláris elektroforézis, migrációs idő, CE, CZE, EOF, UV
tömegspektrométer; ionforrás: elektrospray ionizáció; analizátor: ioncsapda; vákuumrendszer; tömegspektrum: bázicsúcs, bázision, molekulaion, kvázi-molekulaion; fragmentáció: anyaion/prekurzorion, leányion/termékion/fragmension; nitrogénszabály
ESI, IT, MS/MS
Mi az elválasztás alapja a kapilláris zónaelektroforézisnél?
Hogyan adható meg az ion sebessége, és az elektroforetikus mozgékonyság?
Mit nevezünk elektroozmotikus áramlásnak?
Ismertesse a kapilláris elektroforézis készülék felépítését!
Milyen egységekből épül fel egy tömegspektrométer?
Ismertesse az elektrospay ionforrás és az ioncsapda analizátor működését!
Mi a tömegspektrum? Milyen információ nyerhető egy tömegspektrumból?
Mi a tandem tömegspektrometria és mi a jelentősége?
Hogyan lehet megoldani a CE és az MS készülék közti kapcsolatot?