Az atomabszorpciós módszerek során elsősorban termikus energia segítségével alapállapotú szabad atomokat állítunk elő, majd az így létrehozott atomok által elnyelt (abszorbeált) elektromágneses sugárzást (fényt) vizsgáljuk. Ebből a sugárzásból, mely egy külső fényforrásból származik, az atom a gerjesztési energiájának megfelelő hullámhosszúságú fotont elnyeli, és így gerjesztett állapotba kerül (elektrongerjesztés). A sugárzás azon része, mely nem fordítódik a gerjesztésre tovább halad a detektor felé, ahol így fényintenzitás csökkenést mérünk (adott hullámhosszon). Ez a fényintenzitás csökkenés egyértelmű kapcsolatban áll a fényelnyelést okozó atomok koncentrációjával.
Az atomok abszorpciós spektruma éles vonalakból áll (vonalas szerkezetű). E vonalak meghatározott hullámhossznál jelentkeznek és nagyon kicsi, közel 0.001 nm a félértékszélességük. A kis vonalszélesség miatt a különböző elemek jellemző vonalai között nagyon kicsi az átfedés lehetősége. Vagyis egy adott elem legjobb vonalának hullámhosszán a többi atom elnyelésének nagyon kicsi a valószínűsége. Ezért az atomabszorpciós módszerrel összetett, sok elemet tartalmazó minták is elemezhetők az elemek kémiai elválasztása nélkül. Egy atomspektrum nagyszámú vonalai közül rendszerint csak a legkisebb gerjesztési energiával rendelkező vonalat használjuk fel a mennyiségi elemzésre.
1957-ben az ausztrál Alan Walsh és munkatársai építették meg az első atomabszorpciós spektrométert. E készülékek alkalmazása azóta is széleskörű minden olyan területen, ahol kis koncentrációban jelenlevő fémek mennyiségi meghatározása a feladat (pl. talaj-, víz-, levegőminták, ötvözetek, fémek, élelmiszerek, biológiai eredetű minták vizsgálata stb.).
Az atomabszorpciós vizsgálatokhoz szükséges szabad, alapállapotú atomokat többféle módon (lángban, grafitkemencében) előállíthatjuk. Ha a lángban történik a minta atomizálása, akkor lángatomabszorpciós spektrometriáról (FAAS) beszélünk.
A mérés első lépései teljesen azonosak a korábban ismertetett FES módszernél leírtakkal. Vagyis a vizsgálandó mintát beporlasztjuk a lángba. A lángba bejutott cseppek több lépésben a hőenergia hatására átalakulnak, szabad atomok keletkeznek, melyek megfelelő hőenergia hatására gerjesztődhetnek, sőt ionizálódhatnak is. De a láng hőmérsékletén (2000-3000 °C-on) a gerjesztett atomok száma csekély az alapállapotban lévő atomok számához képest. Még a legkönnyebben gerjeszthető elemnél is az alapállapotú atomok számának alig 1%-a lesz gerjesztett állapotban. Ez nagyon előnyös a FAAS mérések szemszögéből.
A méréshez használt készülék felépítése az Atomemissziós spektroszkópia fejezetben az 5.1. ábrával megegyező. A megvilágító fényforrás fénye áthalad a lángon, ahol találkozik a meghatározandó elem alapállapotú atomjaival, majd egy monokromátoron keresztül a fényérzékelő detektorba jut. A monokromátor feladata itt is a láng saját emissziójának kiszűrése, a vizsgált elem rezonanciavonalának kiválasztása. A detektor (legtöbbször fotoelektron-sokszorozó) kimenő jelét erősítik.
Már korábban megemlítettük a láng alapsugárzását, de a vizsgált mintát kísérő komponensek is fényt emittálhatnak magas hőmérsékletű térben. Ha a lángban az ilyen módon keletkező fényemisszió bizonyos komponenseinek hullámhossza megegyezik a vizsgált elem elemző vonalának hullámhosszával, akkor az említett hullámhosszon intenzitásnövekedést tapasztalunk. Ezt a problémát a fényforrás fényének modulálásával (a fény meghatározott időnként történő szaggatásával vagy impulzusszerű megvilágítással) küszöbölhetjük ki.
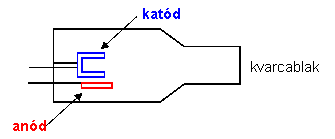
Az atomok keskeny abszorpciós vonalai szükségessé teszik egy speciális fényforrás használatát, amely intenzív vonalas spektrumot tud előállítani ebben a keskeny abszorpciós tartományban. A vájtkatód lámpa (más néven: üregkatód lámpa) megfelel az utóbbi követelményeknek; a vizsgált elem elnyelésének megfelelő hullámhosszúságú vonalas színképet szolgáltat.
A vájtkatód lámpa (5.5. ábra) olyan speciális kisülési cső, amelynek katódja a meghatározandó elemből készül, vagy azzal az elemmel van beborítva. Alakja hengeres vagy csésze formájú. Az anód volfrámból készül, gyűrű vagy zászló alakú lemez. A két elektród neon vagy argon gázzal töltött, hengeres zárt üvegcsőben helyezkedik el. A katód és az anód közé kapcsolt kb. 300-400 V feszültség hatására, a katód elektronemissziója révén, kisülés jön létre. A katódból kilépő elektronok az elektromos erőtérben felgyorsulva nagy sebességgel mozognak az anód felé, miközben a nemesgáz atomokat ionizálják. A pozitív töltésű nemesgáz ionok a katód felé mozogva felgyorsulnak és becsapódva a katód felületébe, onnan alapállapotú fématomokat löknek ki (katódporlasztás). Az alapállapotú atomok a katód felé folyamatosan áramló nagysebességű nemesgáz ionokkal ütközve gerjesztődnek. A gerjesztett atomok visszatérve alapállapotba a katód anyagára jellemző vonalas színképet emittálnak. Az emittált fény félértékszélessége kicsi, intenzitása nagy. Ezek a fényforrások általában egyelemesek (a katód csak egyféle elemet tartalmaz), tehát a különböző elemek meghatározásánál cserélnünk kell a fényforrást.
Az egy elemre egy lámpa probléma egyik megoldása az, hogy többelemes lámpákat gyártanak, amelynek katódja két vagy akár hat elemet is tartalmazhat (pl. ötvözetként). Közel azonos illékonyságú elemekből készítenek ilyen katódot. A többelemes lámpák nem olyan megbízhatók, mint az egyelemesek, élettartamuk is kisebb. Az illékonyabb fém gyorsabban párolog ki a katódból, és rárakódik a többi elemre, azok intenzitását csökkentve. Másik megoldásként az atomabszorpciós spektrométerekben egy forgófejre több lámpát szerelnek fel, és számítógép vezérli a forgófej forgatását.
Az atomabszorpciós (és emissziós) vizsgálatokhoz gázhalmazállapotú szabad atomokat kell létrehozni a mintából (atomizálás). Ez az átalakulás az atomforrásban játszódik le, ami rendszerint egy magas hőmérsékletű tér.
A korábban ismertetett lángot már régóta sikeresen használják atomizáló közegként. Előnye hogy viszonylag egyszerűen és olcsón előállítható, továbbá reprodukálható eredményeket szolgáltat. Hátránya, hogy nagy anyagmennyiséget (néhány cm3) igényel, és a mérendő elemek tartózkodási ideje a (fényelnyelés szempontjából) vizsgált lángrészben viszonylag kicsi, ami korlátozza a módszer érzékenységét.
Az érzékenység növelésére vezették be az elektrotermikus atomizálást. A grafitkemencés atomabszorpciós spektrometriában (GFAAS) az atomizálás egy elektromosan felfűtött grafitcsőben történik. A grafitcsőbe bevitt oldatok, vagy szilárd minták a felfűtés során először elpárolognak, később termikusan atomjaikra disszociálnak. A grafit igen nagy hőmérsékletig hevíthető, jól megmunkálható elem. A felfűtés számítógéppel vezérelt, pontos hőmérsékletprogramozással történik, ami négy részből áll: szárítás, hamvasztás, atomizálás és kiégetés. A GFAAS előnye, a nagy érzékenységén kívül, kicsi mintaigénye, ami néhány (5-100) mikroliter.
Az atomabszorpciós módszer az atomforráson (láng, grafitcső) áthaladó fény intenzitáscsökkenését méri. A vizsgált atom vonalán észlelt fényintenzitás csökkenés és a fényelnyelést okozó atomok koncentrációja közötti összefüggést a Lambert-Beer törvény írja le.
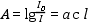
ahol A = abszorbancia [dimenzió nélküli szám]
I0 = a besugárzó fény intenzitása I = a fény
intenzitása az abszorpció után a = abszorpciós koefficiens (anyagi
minőségtől függő állandó) c = az atomforrás egységnyi térfogatában
lévő alapállapotú, szabad atomok száma l = az az úthossz, amit a
fény az atomizáló térben megtesz [cm]
Elvileg, ha a vizsgált mintaoldat koncentrációja nő vagy csökken, akkor a lángban keletkező szabad atomok koncentrációja is hasonlóan változik (bizonyos koncentrációtartományban). Ez a növekedés vagy csökkenés akkor lesz koncentráció-arányos, ha a mérések során a mintabeviteli (porlasztási) körülmények és az atomizáció körülményei a lángban nem változnak.
Anyagok: 100 ppm-es Cu2+-oldat, ismeretlen koncentrációjú Cu2+-oldat
A gyakorlat menete: Készítsük el a következő oldatokat (25,00 cm3-es mérőlombikokban):
Abszorbancia | ||||||
1. lombik | 0,25 cm3 az ismeretlen konc. oldatból, melyet jelre töltünk desztillált vízzel |
|
|
|
|
|
2. lombik | 0,25 cm3 ismeretlen konc. oldat + 0,25 cm3 100 ppm -es Cu2+-oldat → jelre töltjük |
|
|
|
|
|
3. lombik | 0,25 cm3 ismeretlen konc. oldat + 0,50 cm3 100 ppm -es Cu2+-oldat → jelre töltjük |
|
|
|
|
|
4. lombik | 0,25 cm3 ismeretlen konc. oldat + 0,75 cm3 100 ppm -es Cu2+-oldat → jelre töltjük |
|
|
|
|
|
5. lombik | 0,25 cm3 ismeretlen konc. oldat + 1,00 cm3 100 ppm -es Cu2+-oldat → jelre töltjük |
|
|
|
|
|
6. lombik | 0,25 cm3 ismeretlen konc. oldat + 1,25 cm3 100 ppm -es Cu2+-oldat → jelre töltjük |
|
|
|
|
|
Mérjük le az így elkészített oldatok abszorbanciáját 324,8 nm-en (minden egyes oldat esetén 5-ször olvassuk le az abszorbanciát).
Beadandó: Hozzon létre egy hasonló táblázatot, mint ami a K+ meghatározásnál meg volt adva (1.2.1. fejezet). Adja meg az egyes oldatokhoz tartozó abszorbanciák átlagértékeit és az átlaghoz tartozó szórást. Számolja ki az egyes lombikokban lévő Cu2+-oldatok koncentrációját (figyelmen kívül hagyva az ismeretlen Cu2+-oldat koncentrációját). A koncentráció függvényében ábrázolja milliméterpapíron az abszorbanciák átlagértékeit, majd a mérési pontokra illesztett egyenes alapján határozza meg az ismeretlen oldat koncentrációját ppm-ben.
FES: lángemissziós spektrometria (flame emission
spectrometry) FAAS: lángatomabszorpciós spektrometria (flame atomic
absorption spectrometry) GFAAS: grafitkemencés atomabszorpciós
spektrometria (graphite furnace atomic absorption spectrometry) PMT:
fotoelektron-sokszorozó (photomultiplier tube)
Milyen összefüggés írható fel a fény energiája és hullámhossza között?
Milyen folyamatok játszódnak le a porlasztás során keletkező cseppekkel a lángban?
Milyen fő részekből áll az atomabszorpciós spektrométer és mi az egyes részek funkciója?
Milyen típusú részecskéket használhatunk fel az atomabszorpciós és az atomemissziós elemzésekhez; és miért?
Mi a fotoelektron-sokszorozó és a vájtkatód lámpa működési elve?
Írja le a vizsgált fém vonalán észlelt fényintenzitás csökkenés és a fém alapállapotú, szabad atom-koncentrációja közötti összefüggést!
Milyen területeken használható az atomabszorpciós spektrometria és a lángemissziós spektrometria?
Ismertesse a különböző atomforrások előnyeit, hátrányait!
Miért nem célszerű az atomabszorpciós technikában folytonos színképű lámpákat, vagyis egy egyszerű „villanykörtét” használni sugárforrásként?