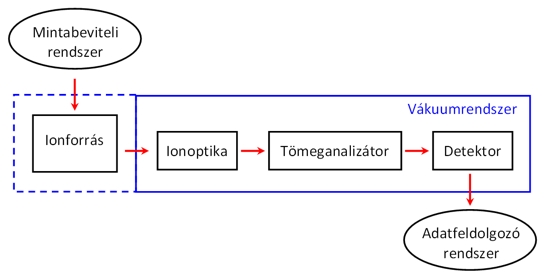
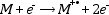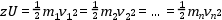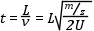A tömegspektrométer egy olyan berendezés, melyben semleges részecskékből (molekulákból, atomokból) ionokat állítunk elő, majd ezeket az ionokat elektromágneses terek segítségével tömeg/töltés arányuk szerint elválasztjuk. A tömegspektrométer felépítése az 9.1. ábrán látható. Az ionforrásban a vizsgálandó molekulákból/atomokból valamilyen gerjesztő energia (kinetikus, fény, elektromos, kémiai, stb.) segítségével ionokat hozunk létre. Az ionoptika biztosítja azt, hogy ezek az ionok lehetőleg azonos kinetikus energiával, egy nyalábban mozgatva bejussanak az analizátorba. A tömeganalizátor válogatja szét őket tömeg/töltés hányadosuk (m/z) alapján. Az elválasztott ionok intenzitását pedig a detektor méri, s így egy ionáram intenzitás - fajlagos tömeg függvénykapcsolathoz, az ún. tömegspektrumhoz jutunk. Ahogy az 9.1. ábrán is látszik a tömegspektrométer jelentős részében légritkított tér (ún. vákuum) van, viszont vannak olyan ionforrástípusok, melyekben légköri nyomáson történik az ionizáció. A mintabevitel módját az alkalmazott ionizációs módszer, az analizátor típusa, de mindenekelőtt a vizsgálandó minta tulajdonságai határozzák meg.
Elvileg tömegspektrométerrel bármilyen halmazállapotú anyag vizsgálható, mivel ionforrás típustól függően gáz, folyadék és akár szilárd minta is ionizálható. Direkt vagy közvetlen mintabevitelt célszerű választani, ha egykomponensű mintánk van; míg egy összetett, többkomponensű elegy esetében valamilyen szeparációs lépést (GC, LC, CE, stb.) követően ajánlott bejuttatni a mintát az ionforrásba. Speciális illesztőegységek (interfészek) biztosítják az elválasztástechnikai készülékek és a tömegspektrométer között a kapcsolatot.
Elektronütköztetéses ionizáció (Electron Impact, EI). Az elektronütköztetéses ionizáció a legrégebbi, de ma is igen széles körben alkalmazott ionizációs technika. A molekula elektronokkal ütközve ionizálódik, miközben páratlan elektronszámú gyökkation (M+∙) képződik belőle. Ezt nevezzük molekulaionnak, mely tömege gyakorlatilag megegyezik a molekuláéval, a különbség 1 e− tömegének felel meg.
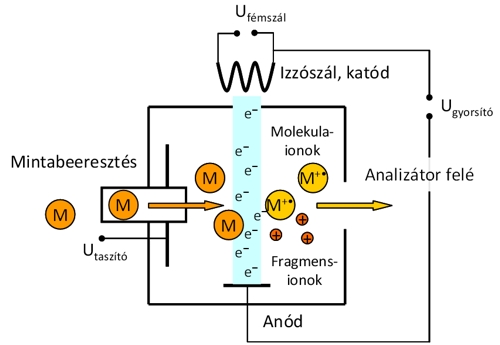
Az elektronokat egy fémszál (pl. volfrámszál) hevítésével, ún. izzó katódból nyerjük, számukat az izzószál hőmérsékletével (az izzószálon áthaladó áram nagyságával), energiájukat az alkalmazott gyorsító feszültség változtatásával befolyásolhatjuk.
A rugalmatlan ütközés során az elektronok energiájuk egy részét átadják a molekuláknak, amely nem csak a molekulák ionizációjára, hanem gerjesztésére is fordítódik. A gerjesztett állapotban lévő ionok további reakciókon (pl. kötéshasadás vagy átrendeződés) mehetnek keresztül belső energiájuktól függően. A gyakorlatban általában 70 eV kinetikus energiájú elektronokkal ütköztetik a mintát, ekkor jól reprodukálható, informatív EI(+) tömegspektrumokat kapunk. A molekulaion móltömeg információt, míg a fragmensionok megjelenése szerkezeti információt szolgáltat a vizsgált vegyületről. Az EI ionizációs technika hátránya, hogy a nagy gerjesztési energia miatt sokszor a fragmentáció oly nagymértékű, hogy a molekulaion nem detektálható. Ilyen esetekben segíthet, ha csökkentjük az ionizációs energiát 10-20 eV-ra, ami még mindig elég az ionizációhoz, viszont nő a molekulaion stabilitása, csökken a fragmensek mennyisége. Mivel a mintát el kell párologtatni, így csak illékony vegyületek vizsgálhatók ezzel a módszerrel, míg sók, nagyobb molekulák, és a termikusan labilis anyagok nem. Gyakran direkt elpárologtatással juttatjuk a mintát a készülékbe, de a berendezés kényelmesen társítható gázkromatográffal is, mellyel hatékonyan szétválaszthatók és vizsgálhatók összetett minták komponensei is.
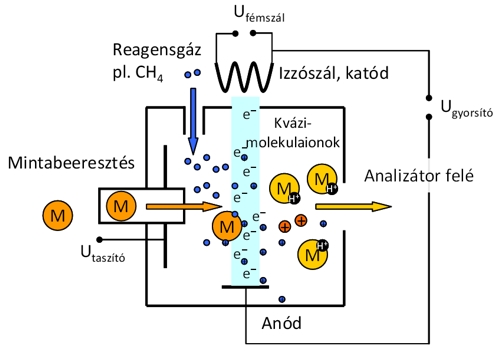
Kémiai ionizáció (Chemical Ionization, CI). A CI és az EI forrás felépítése lényegében azonos, csak az ionizáció mechanizmusa eltérő. A mérendő mintát az elektronforrás előtt valamilyen reagensgázzal (pl. metán, izobután, ammónia) hígítjuk. A forrásban az elektronok nem a minta, hanem a jóval nagyobb mennyiségben jelenlévő reagensgáz molekuláit ionizálják. A CI folyamatban a vizsgált molekula a reagensgázból képződő ionnal ütközik, ion–molekula reakciók (pl. protontranszfer) során ionizálódik. A mintából kvázi-molekulaion (pl. protonált molekulaion, [M+H]+) képződik, mely gerjesztési energiáját a reagensgáz és a mintamolekula protonaffinitás-különbsége határozza meg. A CI a lágyionizációs módszerek közé tartozik: kíméletesebb eljárás, jóval kisebb mértékű a fragmentáció, mint az EI technikánál, viszont emiatt kevesebb a spektrumokból nyerhető szerkezeti információ is. A mintát ennél a módszernél is el kell párologtatni, így ezzel is csak hőstabil, illékony vegyületek vizsgálhatók.
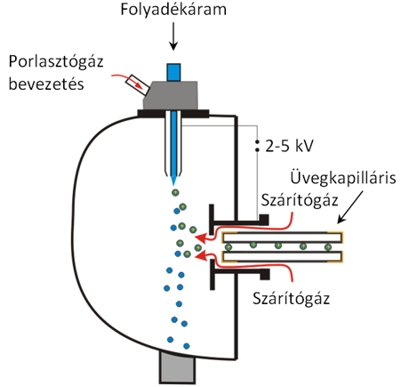
Elektrospray ionizáció (Electrospray Ionization, ESI). Az ESI technika a folyadékkromatográfiás módszerekkel együtt vált népszerűvé az elmúlt évtizedekben. A vizsgálandó nem-illékony, ionos vagy poláris vegyületet valamilyen viszonylag illékony, poláris oldószerben oldjuk. A mintaoldatot egy nagyfeszültségű kapillárison keresztül juttatjuk a légtérbe: az elektrosztatikus tér hatására a kapilláris végén lévő folyadék felszínén töltéstöbblet képződik, így a kapillárisból kilépő folyadék kúpszerűen kicsúcsosodik, s a csúcsáról töltéssel rendelkező folyadékcseppek szakadnak le. A ma már egyeduralkodó ESI technikánál ezt az ionspray technikát aerodinamikus porlasztással kombinálják: a fémkapillárissal koaxiálisan elhelyezkedő külső csőben egy inert porlasztógázt (pl. N2) alkalmaznak a töltött aeroszol létrehozására. Az oldószer mennyiségének csökkentésére a képződött aeroszolt egy fűtött kapillárison vezetjük át. A párolgás során a cseppek mérete folyamatosan csökken, viszont töltésük nem változik, így jelentősen megnövekszik a felületi töltéssűrűségűk, instabillá válnak, végül kisebb cseppekre, majd ionokra szakadnak. A cseppek zsugorodását, a minta ionjainak deszolvatációját/ dehidratációját szárítógáz alkalmazásával (ún. nitrogénfüggöny) fokozzák (lásd 9.4. ábra).
Az ESI napjaink egyik legáltalánosabban használt lágyionizációs technikája, amely segítségével elválasztás nélkül, keverékekből is megállapítható a vizsgálni kívánt molekula tömege, valamint a fragmensekből szerkezeti információ is nyerhető. Ez a technika könnyen protonálódó, bázikus csoportokat tartalmazó vegyületek (aminok, peptidek, fehérjék stb.) vizsgálatára alkalmas leginkább, s valamennyi analizátor típussal kombinálható. Az M>1000 Da tartományban ESI körülmények között a többszörös protonálódás / deprotonálódás eredményeként többszörösen töltött ([M+nH]n+, [M–nH]n–) ionok is képződhetnek, ahol n az adott ion töltéseinek száma. Az apoláris vegyületek ESI-vel nem, vagy csak alig vizsgálhatóak. Ilyen esetekben gyakran jól használható a légköri nyomáson történő kémiai ionizáció (APCI) vagy a fotoionizáció (APPI).
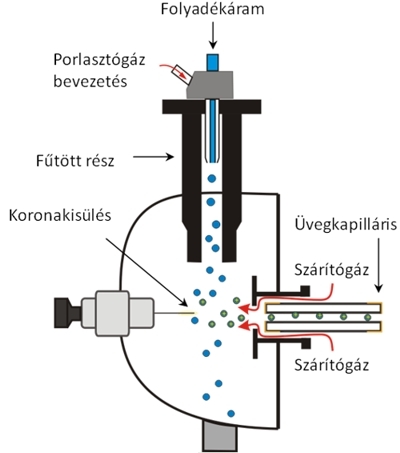
Atmoszférikus nyomású kémiai ionizáció (Atmospheric Pressure Chemical Ionization, APCI). Az APCI ionforrás kivitelezése hasonló az ESI-hez, itt is porlasztással hozzuk létre a cseppeket, viszont a fémkapillárison nincs nagyfeszültség, a sprayképződés és az ionizáció egymástól független folyamat. Az APCI ionizációban az ionok koronakisülés révén jönnek létre. A koronakisülés hatására a víz- vagy más oldószermolekulák ionizálódnak, majd ezek lépnek reakcióba a mintamolekulákkal, miközben kvázi-molekulaionok ([M+H]+, [M–H]–) képződnek. Az APCI kisebb, poláris, de nem feltétlenül ionos molekulák vizsgálatára alkalmas.
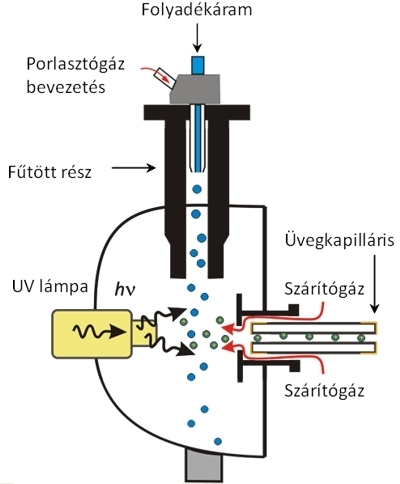
Atmoszférikus nyomású fotoionizáció (Atmospheric Pressure Photoionization, APPI). Az APPI ionizáció során a mintához olyan adalékanyagot, segédfolyadékot (pl. toluol) kevernek, mely az UV-tartományban jelentős elnyeléssel rendelkezik. Az oldatot a porlasztás közben UV-fénnyel besugározzuk, a mintamolekulákat végül a gerjesztett adalékmolekulák ionizálják. Ezzel a módszerrel kis, apoláris molekulák vizsgálhatóak.
Mátrix segített lézer deszorpció és ionizáció (Matrix-Assisted Laser Desorption/Ionization, MALDI). A MALDI alapjába véve vákuum ionizációs technika volt, viszont napjainkban már légköri nyomáson is alkalmazzák. A módszer alapja az, hogy a mintát olyan mátrix oldatával (pl. 2,5-dihidroxi-benzoesav, α-ciano-4-hidroxi-fahéjsav) kell összekeverni, mely az alkalmazott lézer hullámhosszánál fényelnyelést mutat. Ezt a mátrix-minta oldatot rászárítjuk a mintatartóra, majd a szilárd mikrokristályokat besugározzuk a lézer fénnyel. A fotonok többségét a mátrix molekulák abszorbeálják, gerjesztődnek. Majd a mintát tulajdonképpen a gerjesztett, ionizált mátrixmolekulák fogják ionizálni, miközben egy lépésben végbemegy a lézer deszorpció és ionizáció. Az ionizáció eredményeképpen kvázi-molekulaionok képződnek. Ezzel az igen érzékeny módszerrel (fmol tartomány) nagy molekulatömegű (>300 kDa), poláris vagy könnyen polarizálható mintákat vizsgálhatunk. Keverékek egyidejű analízise is lehetséges, nincs szükség bonyolult tisztítási, elválasztási lépésekre.
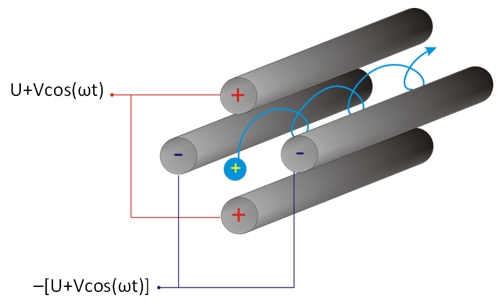
Egy kvadrupól tömeganalizátor négy párhuzamosan elhelyezkedő, elektromosan vezető fémrúdból, elektródból áll. A rudakra egyen- és váltófeszültséget is kapcsolunk úgy, hogy az átlósan egymással szemben elhelyezkedő elektródok potenciálja megegyezzen, az egymás melletti rudak potenciálja pedig ellentétes előjelű legyen. Az ionforrásból kilépő ionok a gyorsító feszültség hatására hosszanti irányból belépnek a rudak közti térrészbe, majd az analizátorban a folyamatosan változó kvadrupólus elektromágneses tér hatására fajlagos tömegüktől függő pályára (trajektóriára) állnak. A pozitív töltésű ionokat az éppen pozitív töltésű rudak taszítani, míg a negatív töltésűek vonzani fogják. Miközben a váltófeszültség hatására az elektródok relatív töltése folyamatosan változik, az ionok oszcillációs mozgást végezve haladnak a rudak között. A rudakra kapcsolt váltó- és egyenfeszültség megfelelő megválasztásával elérhető, hogy az analizátoron csak egy kiválasztott m/z értékkel rendelkező ionok juthassanak át, az összes többi ion – a kisebbek és a nagyobbak is – a rudakba ütközve semlegesítődnek. Emiatt tömegszűrőnek is hívják a kvadrupól analizátort. A mérés történhet folytonos pásztázással, a teljes tömegspektrumok rögzítésével (Scan módban) vagy ún. SIM (Single Ion Monitoring – egyedi ion detektálás) módszerrel, amikor kizárólag egy kiválasztott m/z értékkel rendelkező ionokat detektálunk.
A gyakorlatban a kvadrupól készülékek alacsony (un. egységnyi) felbontás mellett üzemeltethetőek, méréshatáruk néhány ezer Da. Az ilyen berendezések relatíve egyszerűek, könnyen vezérelhetőek, gyorsak, bármilyen ionforrással vagy elválasztástechnikai eszközzel kombinálhatóak (lásd GC-MS, LC-MS gyakorlat).
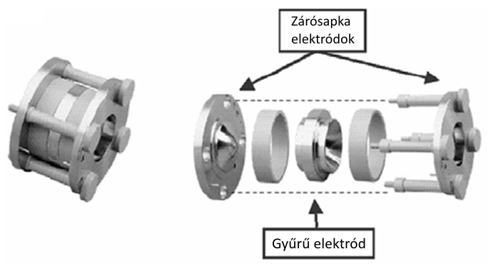
Egy ioncsapda tömeganalizátor három hengeresen szimmetrikus elektródból áll: egy gyűrűből és két lezáró „sapkából”. Mindegyik elektród nagyon pontosan megmunkált hiperbolikus felülettel rendelkezik, és ugyanúgy, mint a kvadrupólus analizátornál, itt is egyen- és váltófeszültséget kapcsolunk rájuk. A csapda belsejében egy alternáló, háromdimenziós kvadrupólus tér alakul ki, mely hatására az ionok fajlagos tömegüktől függően különböző periodikus pályákra állnak, miközben az analizátorban tárolódnak. A csapdázást követően, változtatjuk a kvadrupólus teret, mely hatására az ionok növekvő m/z arány sorrendben kilépnek az analizátorból. Az ionok között a csapdában taszító kölcsönhatások is érvényesülhetnek, egymás erőterében eltérülhetnek. Ezek a tértöltés effektusok jelentősen befolyásolják az ioncsapda dinamikus tartományát. Az ilyen jellegű, koncentrációfüggő kölcsönhatások csökkenthetőek, ha a csapdába He gázt vezetünk; javul a készülék érzékenysége és a felbontás is.
Az ioncsapda analizátor alkalmazásának talán leglényegesebb előnye a tandem tömegspektrometria (MS/MS és MSn kísérletek), többszörös tömeganalízis lehetősége. A csapda képes adott m/z értékű ionokat tárolni, ezek az ún. anyaionok vagy prekurzorionok. A csapdázást követően az ionok energiáját szabályozott körülmények között növeljük, ami azt eredményezi, hogy a csapdában lévő He atomokkal való ütközések az ionok disszociációjához, fragmentálódásához vezetnek, a képződő termékionokat (ún. leányionokat) detektálva MS2 (vagy másképp MS/MS) spektrumhoz jutunk. Természetesen ezt a folyamatot a képződő leányionok egyedi izolálásával, majd azok bomlás termékeinek vizsgálatával tovább folytathatjuk (MSn, n akár 10 is lehet elvileg). Reakciócsatornák nyomon követésével (selected/multiple reaction monitoring: SRM vagy MRM) növelhető az MS módszer szelektivitása és érzékenysége. A módszer lényege, hogy szelektíven csak az adott vegyületre jellemző egy vagy több diagnosztikus fragmension(ok) intenzitását mérjük.
Az ioncsapda előnyei a kvadrupól analizátorral szemben a nagyobb érzékenység, gyorsabb pásztázási sebesség, szélesebb tömegtartomány, nagyobb tömegfelbontás, MSn mérési lehetőség. Hátránya a gyengébb kvantitatív meghatározási lehetőség elsősorban a minta mennyiségétől függő effektusok miatt.
Az ionforrásban előállított ionok egy gyorsító feszültség (U: gyorsító feszültség) hatására elindulnak az analizátor felé. Töltéssel rendelkező részecskék elektrosztatikus térben a töltésükkel arányos kinetikus energiára tesznek szert. Amennyiben azonos töltésű (z: töltés) ionokról van szó, ezek az elektrosztatikus gyorsítást követően azonos kinetikus energiával rendelkeznek.
Amint az ionok belépnek az analizátorba, egy erőtérmentes térrészbe, ún. repülési csőbe kerülnek, ahol kinetikus energiájuk már nem változik. Az azonos kinetikus energiával rendelkező, de különböző tömegű ionok különböző sebességgel repülnek, tehát a repülési csőben elkülönülnek, majd különböző időben érik el a detektort. A nagyobb tömegű ionok lassabbak, míg a kisebb tömegű ionok gyorsabbak. A repülési idő az adott ionforrás-detektor távolság (L) és gyorsító feszültség mellett csak a fajlagos tömegtől (m/z) függ. A pontos tömegméréshez az szükséges, hogy az ionok egyszerre, impulzusszerűen lépjenek be a repülési csőbe, és repülési idejüket pontosan tudjuk mérni.
9.9. ábra - TOF analizátor működési elve. A MALDI ionforrásban impulzusszerűen előállított ionok az U gyorsítófeszültség hatására belépnek az erőtérmentes repülési csőbe, ahol fajlagos tömegük alapján elkülönülnek.
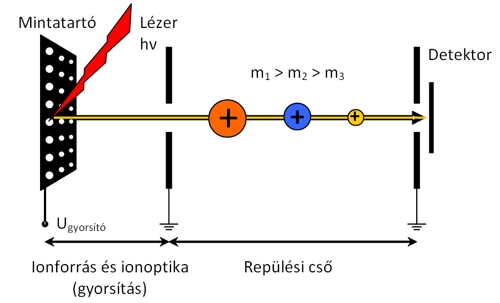
A TOF analizátorokkal igen nagy móltömegű molekulákat is lehet vizsgálni (106 Da), az elérhető maximális felbontás általában 10000–20000 között van. Az ionokat impulzusszerűen detektálja a készülék, pásztázás nélkül, ami nagyságrendekkel növeli az érzékenységet; ráadásul az analizátor nagyon gyors működésű, hiszen egy-egy ion repülési ideje 10–5–10–7 s intervallumba esik. A TOF analizátorokat elsősorban MALDI ionforrással kombinálva alkalmazzák.
A tömegspektrométerek jelentős részében vákuum van (kivételt képeznek a légköri nyomáson működő ionforrások), mivel a levegő jelenléte zavarná a tömeganalízist, az ionok detektálást. Az ionoknak el kell jutniuk az ionforrástól a detektorig anélkül, hogy különféle gázmolekulákkal ütköznének. Az ütközés, kölcsönhatás energiaveszteséggel járhat, miközben a részecskék haladási iránya is megváltozik, ami azt eredményezi, hogy nem tudjuk a fajlagos tömegüket pontosan megmérni.
A tömegspektrométerekben a vákuumot a legalább kétfokozatú vákuumrendszer állítja elő. Általában rotációs szivattyú biztosítja az elő- és középvákuumnak megfelelő nyomásértéket (103–10-3 mbar). A nagyvákuum-szivattyúk előtti terekben, illetve a mintabeeresztő-rendszer külső részeiben jellemző ez az nyomástartomány. Nagyvákuumban (10-3–10-9 mbar) megy végbe pl. az EI ionizáció, a tömeganalízis és a detektálás, ezt diffúziós vagy turbómolekuláris szivattyúk segítségével érhetjük el.
Tömegspektrum: Az ionok relatív intenzitása (a legintenzívebb ionok intenzitásának százalékában kifejezett intenzitás) és a fajlagos tömege közötti kapcsolat szolgáltatja a vegyületre jellemző tömegspektrumot.
Báziscsúcs, bázision: A tömegspektrumban lévő legintenzívebb csúcsot báziscsúcsnak, az ennek megfelelő iont bázisionnak nevezzük.
Névleges tömeg: A névleges tömeget a jelenlévő elemek legnagyobb természetes gyakoriságú izotópjainak egészekre kerekített tömegéből számítjuk.
Monoizotópos tömeg: A monoizotópos tömeget a jelenlévő elemek legnagyobb természetes gyakoriságú izotópjainak pontos tömegéből számítjuk.
Átlagos (kémiai) tömeg: Az átlagos tömeg megadásánál a jelenlévő elemek tömegét a természetes izotópeloszlásuknak megfelelően vesszük figyelembe
Felbontás (R): A tömeganalizátor felbontása, azt fejezi ki, hogy milyen tömegkülönbséggel tud két iont – egy m és egy m+Δm csúcsot – elválasztani. R=m/Δm
Izotópeloszlás: Az elemek általában izotópok keverékei, kevés monoizotópos elem ismert. A természetes izotópeloszlásnak megfelelően az egyes ionok különböző izotópokat tartalmaznak, és mivel az izotópok tömege különböző, ezért ezek önálló, jól elkülönülő csúcsként jelennek meg a tömegspektrumban, jellegzetes eloszlással. Egy egyféle atomot tartalmazó ion sávcsoportjának az intenzitás viszonyai az (a+b)n binomiális eloszlást követik, ahol a a könnyű, b a nehéz izotóp természetes gyakoriságát, n az adott atom számát jelenti.
Nitrogénszabály: Páros számú nitrogént tartalmazó molekulák móltömege mindig páros. Páratlan számú nitrogént tartalmazó molekulák móltömege pedig mindig páratlan.
Magyarázat:
Páros tömeg páros vegyérték: pl. –CH2–, –O–, –S– stb.
Páratlan tömeg páratlan vegyérték: –F, –Cl, –Br, –I
Páros tömeg páratlan vegyérték, vagy páratlan tömeg páros vegyérték: –N=, –NH2 vagy =NH