Az elektroforetikus mikrochip technika a fehérjék méretének, mennyiségének, tisztaságának egyidejű meghatározására alkalmas, ezért fehérje analitikai és proteomikai célokból egyaránt használatos. Előnyei elsősorban a kis anyagigény, gyorsaság és könnyű kezelhetőség. A minták felvitele egyszerű pipettázással, festése és detektálása zárt rendszerben, automatikusan történik. Mikrofluidikai chipekkel nagy érzékenységgel, reprodukálhatóan végezhetők a futtatások 4 μl mintatérfogatból. Az elektroforézis során kapott digitális jelek elektroferogram, gélkép, valamint adattáblázat formájában kerülnek bemutatásra. Egy chipen 10 minta futtatható fél órán belül.
A modern bioanalitika és molekuláris biológia leggyakrabban használt, nagy hatékonyságú módszereinek jó része az elektroforézis elvén alapulnak. Az elektroforézis elve szerint az oldat töltéssel rendelkező részecskéi elektromos erőtér hatására elmozdulnak. (Bővebben ld. a Kapilláris elektroforézis fejezetet.)
Napjaink fő irányvonala a nagy hatékonyságú, automatizált rendszerek fejlesztése. A miniatürizálás az elválasztás-technikák körében is egyre inkább megjelenik, ez eredményezte az elektroforetikus mikrochip kifejlesztését. A chip csatornáiban történő folyadéktranszport több lépés összevonását teszi lehetővé (keverés, elválasztás, hígítás, detektálás), ezért is kapta a chiplabor nevet („lab-on-a-chip”). A hagyományos módszerekhez képest lényegesen lerövidül az elektroforetikus analízisek időtartama (perc-másodperc nagyságrend), többcsatornás rendszerek alkalmazásával párhuzamosan több minta vizsgálata válik lehetővé. A mikrofluidikai chipek analitikai alkalmazása 1990-től indult el.
A molekulák elválasztása kisméretű üveglapba maratott, 10-40 μm mély és 50-200 μm széles csatornákban történik. A csatornák a mikrochip felszínén lévő nyílásokban végződnek, amelyek az oldatok (minta, puffer, elválasztó mátrix) bejuttatására szolgálnak. A betöltő nyílásokba merülő elektródok segítségével az egyes csatornákban különböző nagyságú és polaritású elektromos mező alakítható ki, mely alkalmas a mikrochipen az anyagok mozgatására és a minták elektroforetikus elválasztására.
A mikrochipek készítésére üveget, műanyagokat használnak, illetve hibrid chipek is léteznek. Az üveg chip a legelterjedtebb, mert olcsó, hidrofil, kémiailag inert, tartós, optikailag tiszta és nem porózus. Háromféle üveg chip létezik: a boroszilikátos üveg, a nátrium-CaCO3 keverék üveg és a kvarcüveg.
A chipek működési elvét jól szemlélteti az ún. keresztcsatornás mikrochip vázlata (8.11.ábra). Ezek a legegyszerűbb mikrochipek két, egymást keresztező csatornát tartalmaznak. A rövidebb csatorna a minta injektálására, a hosszabb az elektroforetikus elválasztásra szolgál.
Első lépésként a mikrochipet feltöltjük molekulaszűrő sajátságú polimer mátrix-oldattal. A mátrixoldat nagy molekulatömegű polimert, poli(dimetilmetakrilát)-ot (PDMA) tartalmaz Tris-glicin pufferben. A puffer fluoreszcens festéket és SDS-t is tartalmaz. Lényeges ellenőrizni, hogy a csatornák valóban feltöltődtek-e teljesen, nem képződött-e valahol buborék (ez szabad szemmel is látható). Ezután a 4. helyre visszük fel a mintát, az 1. és 3. helyre pedig a futtató puffert, mely rendszerint azonos az elválasztáshoz használt polimerrel. Az elektroforézis első lépése a minta injektálása, ennek során a 4. tartályból a 2. tartályba áramolva a rövid csatorna megtöltődik mintával. Az ezt követő elválasztásban a mintának csak kis része vesz ténylegesen részt, amely épp a két csatorna kereszteződésében van (25 pL).
Az elválasztás során a feszültségeket úgy állítjuk be, hogy a kapillárisok kereszteződésében lévő molekulák a 3. hely felé mozdulnak el, a minta többi része viszont lassan visszaáramlik a minta- (2. hely), illetve a gyűjtőtartályba (4. hely). Ennek köszönhetően a minta nem szivárog be az elválasztó csatornába és a létrejött „minta-dugó” éles csúcsokat ad.
Az elválasztást követően történik a detektálás, a hosszanti kapillárisban, még a 3. mintagyűjtő előtt. Detektálás módja több-féle lehet: UV/VIS detektor, lézer indukált fluoreszcens detektálás, tömegspektrométer, stb.
Természetesen ma már ennél jóval bonyolultabb felépítésű chipek léteznek, melyeken akár 10-96 mintát is vizsgálhatunk egyszerre.
Agilent 2100 Bioanalyzer. A gyakorlaton használt készülék fehérjék, DNS, RNS illetve sejtek vizsgálatára egyaránt alkalmas. A sejtek vizsgálata az áramlási citometria alapelvein nyugszik, míg a fehérje, DNS és RNS vizsgálata elektroforézisen alapul.
Protein 80/230 Plus rendszer. A chipek üvegből készülnek, melyek 65-75 % szilíciumot, 12-18 % nátriumot és 5-15 % CaCO3-ot tartalmaznak. A kapillárisokat fotolitográfiás technikával, úgynevezett nedves-maratással alakítják ki. A kapillárisok 10 μm mélyek és 50 μm szélesek. Maga a chip felülete 17.5 mm2.
Az elválasztás során használt polimer oldat egy nem keresztkötött poliakrilamid származék, mely lecsökkenti az elektroendozmózist (EOF, bővebben ld. a Kapilláris elektroforézis fejezetet), ezért a kapillárisokat nem kell bevonni. Az EOF csökkenése a határfelület viszkozitásának megnövekedésével és a polimer kapillárisfalhoz történő adszorpciójával magyarázható. Első lépésben ezzel a polimer oldattal feltöltjük a chip kapillárisrendszerét, nyomás alkalmazásával. A polimer oldathoz fluoreszcens festéket is keverünk, ez jelöli majd meg a fehérjéket, a jelölés a chip-ben történik.
A fehérjemintákhoz az előkészítés során egy denaturáló puffert adunk, mely 4% SDS-t, belső markereket és hozzáadott redukálószert (merkaptoetanolt vagy ditiotreitolt=DTT) tartalmaz. A denaturáló pufferrel 5 percig 100°C-on inkubáljuk a fehérje mintákat.
A negatív töltésű SDS a peptid hidrofób részeihez kapcsolódva egyrészt megbontja a fehérje natív szerkezetét, másrészt méretarányos mennyiségben asszociálódik a fehérjékkel, s így a mérettel arányos negatív töltést kölcsönöz nekik. A fluoreszcens festék ezen az SDS-burkon keresztül kötődik a fehérjékhez. A fehérjékben található diszulfid-hídakat az SDS nem bontja meg, erre a merkaptoetanol/DTT-t használjuk. A redukálószerek és az SDS együttesen vezetnek az alakfaktor kiküszöböléséhez, ezért a mikrochipen méret alapján történik a fehérjék elválasztása.
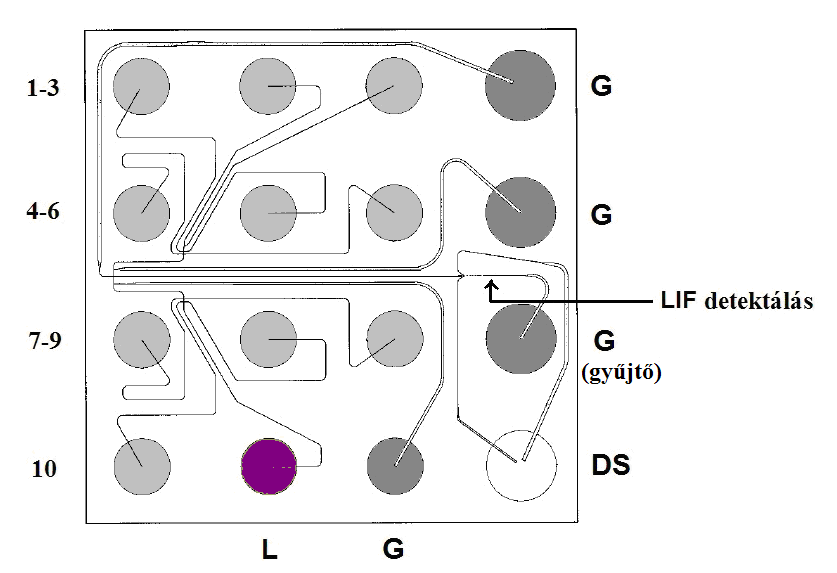
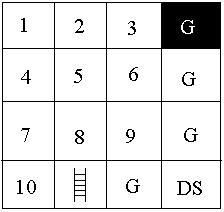
Az injektálás a minta tartályokból (1-10-ig számozva a 8.13. ábrán) egymás után (szekvenciálisan) a már említett módon történik a feszültség rákapcsolásával. Az elválasztás a középen elhelyezkedő szeparáló csatornában megy végbe. A detektálási pont előtt, a DS (diluting solution) jelű tartályból két oldalról becsatlakozó csatornák segítségével történik a fluoreszcens festék kihígítása, ennek következtében csökken a háttérzaj és egy nagyságrenddel megnő a minta csúcsmagassága. A detektálás lézerindukált fluoreszcens detektorral történik.
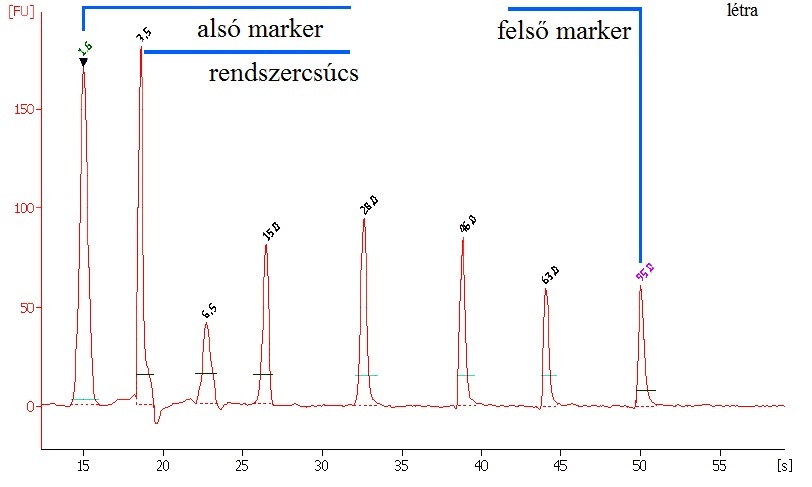
A minták kiértékelését külső és belső standardok segítik. A minták mellett, külön futtatunk egy standard fehérje sorozatot, ún. ladder-t (létrát). Valamint a denaturáló pufferrel együtt minden mintához hozzáadunk belső markereket is, egy alsó illetve egy felső markert (8.14. ábra).
A használt szoftver (2100 Expert) elektroferogramként, gélképként és táblázatos formában is megjeleníti a kapott eredményeket. Az elektroferogram esetében a fluoreszcens intenzitást ábrázolja a vándorlási idő függvényében. Minőségi információt a csúcsok helye, azaz a vándorlási idő szolgáltat, mennyiségi információt a csúcs alatti terület ad. A program a mennyiségi kiértékeléshez mindig a felső marker koncentrációját veszi alapul, mely minden mintában azonos. Minőségi kiértékelésnél a belső markerek alapján automatikusan értékeli a mintákat, majd táblázatos formában jeleníti meg a minta komponenseinek a méretét (kDa) és koncentrációját (ng/µl).
A festék koncentrátumot és a gél mátrixot hagyjuk szobahőmérsékletre melegedni.
650 μl (1 csőnyi) gél mátrixot pipettázzunk át egy szűrővel ellátott csőbe.
Centrifugáljuk 2500 g ± 20 % fordulattal 15 percig.
A lecentrifugált és szűrt gélhez adjunk 25 μl, jól felkevert festék oldatot.
Vortexeljük alaposan a keveréket 15-20 másodpercig, míg az oldat egységes kék színű lesz.
A kész keverék fényérzékeny! 4˚C-on, sötétben tárolva 4 hétig eltartható.
Pipettázzunk 650 μl gél mátrixot egy szűrővel ellátott csőbe.
Centrifugáljuk 2500 g ± 20 % fordulattal 15 percig. 4 ˚C-on tárolható.
Pipettázzunk 7 μl merkaptoetanolt egy mintapuffer csőbe.
Vortexeljük 5 másodpercig. 4˚C-on tárolva 4 hétig eltartható.
0,5 ml-es Eppendorf-csőbe 4 μl protein mintát (szobahőmérsékletű) és 2 μl denaturáló oldatot mérjünk be. (Egy chipre maximum 10 mintát lehet felvinni.)
Mérjünk be egy másik 0,5 ml-es Eppendorf-csőbe 6 μl molekulasúly markert.
A csöveket alaposan vortexeljük, majd tegyük 5 percre 100˚C-os termosztátba. Majd hagyjuk kihűlni és 15 másodperces centrifugálással koncentráljuk.
Pipettázzunk minden csőbe 84 μl ionmentes desztillált vizet (1:15 hígítás) és vortexeljük 5 másodpercig.
Helyezzünk az A pozícióban lévő chip-előkészítő állványra egy protein chipet. A rögzítőfülnek középső állásban kell lennie.
12 μl gél-festék mátrixot pipettázzunk a fehér G jelű nyílásba.
Állítsuk a dugattyút 1 ml-re és zárjuk le a chip-előkészítő eszközt. Nyomjuk le a dugattyút annyira, hogy a rögzítőfül záró helyzetbe kerüljön (3 bar).
Várjunk pontosan 60 másodpercig, majd a rögzítőfül kipattintásával engedjük fel a dugattyút. Várjunk 5 másodpercig, majd lassan húzzuk vissza a dugattyút az eredeti 1 ml-es állásba. Nyissuk fel a chip-előkészítő eszközt.
Ezután pipettázzunk 12 μl gél-festék mátrixot a fekete és a fehér G jelű nyílásokba.
Pipettázzunk 12 μl festékmentesítő oldatot (festék nélküli gél) a DS jelű tartályba.
Pipettázzunk 6 μl előkészített mintát a 10 minta tartályba (sorszámozott). A mintaoldatok az alsó és felső fehérjemarkereket is tartalmazzák.
Pipettázzunk 6 μl előkészített molekulasúly markert a létra jelzésű tartályba.
A feltöltött chipet helyezzük be a Agilent 2100 Bioanalyzer chipkészülékbe és kezdjük el azonnal a chip futtatását.
Fehérje ill. endotoxin minták elválasztása Protein 80/230 Plus mikrochipen
Ismert koncentrációjú fehérje standardok (albuminok, hemoglobin, transzferrin, laktoferrin, glikoprotein-orosomucoid) ill. endotoxinok (E. coli O83, Salmonella adelaide O35, Proteus morganii 352, Salmonella minnesota R595) elkészítése és mérése elektroforetikus mikrochip módszerrel.
A minta csúcsok meghatározása és adatainak felvétele (molekulatömeg, vándorlási idő, fluoreszcencia intenzitás, csúcs alatti terület).
A lemért minták elektroferogramjának felvétele és kiértékelése.
A kiértékelés táblázatos formáját elkészíteni (minta neve, irodalmi molekulatömege, mért molekulatömege, vándorlási ideje, fluoreszcencia intenzitása, koncentrációja).
Az előzőek segítségével fehérje-meghatározás összetett (több fehérjét tartalmazó) mintából, mennyiségi meghatározás (koncentráció)
elektroforézis, EOF, LIF detektor, SDS, DTT, létra (molekulasúly marker), elektroferogram, fluoreszcencia intenzitás, vándorlási idő
Ismertesse az elektroforézis elvét!
Mi az EOF, milyen áramlási profilt eredményez?
Rajzoljon fel egy egyszerű, keresztcsatornás mikrochipet. Hogy zajlik egy elválasztás ezen a chipen?
Mi az SDS, miért használjuk?
Nevezzen meg néhány redukálószert, mi a szerepük?
Soroljon fel minimum 3 detektálási módot, a gyakorlaton milyen detektálást használt?
Különböző (minimum 2-3) fehérjéket tartalmazó mintát vizsgál mikrochip készülékkel. Vázolja fel az elektroferogramot (jelölje a tengelyeket is). Hogyan határozná meg a fehérjéket, mi szolgáltatja a minőségi, illetve a mennyiségi információt?
Műszeres analitika előadások – kapilláris elektroforézis
Dr. Gáspár Attila: Kapilláris zónaelektroforézis, 2000, Egyetemi Kiadó
G2938-90062 Agilent Protein 80 Reagent Kit GuideUser Manual 9/19/2006
G2946-90004 Agilent 2100 Bioanalyzer 2100 Expert User’s GuideUser Manual 6/21/2005