A folyadékkromatográfia megjelenésével megoldódott azon vegyületek elválasztási problémája, amelyek nem elég illékonyak illetve származékképzéssel sem alakíthatók illékonnyá a gázkromatográfiás elemzésekhez.
A nagyhatékonyságú folyadékkromatográfia (High Performance Liquid Chromatography: HPLC) kifejlődése az 1960-as évek közepére tehető. Napjainkig olyan fejlődésen ment keresztül, hogy az elválasztástechnikai eljárások közül az egyik leggyakrabban alkalmazott analitikai módszerré vált, mind a kutatás, mind a rutinvizsgálatok során. Alkalmazási területei közül fontos szerepe van a gyógyszeranalitikai vizsgálatokban (mennyiségi- és minőségi analízisben, reakcióutak nyomon követésében, bomlási folyamatok kimutatásában), az élelmiszeripari vizsgálatokban (vegyszermaradványok: peszticidek, színezékek, különböző hatóanyagok: polifenolok, zsír- és vízoldékony vitaminok meghatározásában), a toxikológiai vizsgálatokban (droganalízisben, gyógyszer hatóanyag minőségi és mennyiségi elemzésében), a környezetanalitikai mérésekben (poliaromás szénhidrogének, növényvédőszer maradványok, toxikus vegyületek analízisében) és nem utolsó sorban egyre több feladatot kap a kutató laboratóriumok elválasztástechnikai feladatainak megoldásában.
A HPLC készülékek használata során nagy nyomáson kényszerítjük át a mozgófázist a kis szemcseméretű állófázison, ahol megtörténik az elválasztás. A rendszerben uralkodó nyomásesés, valamint az elválasztás hatékonysága az alkalmazott álló- és mozgófázis minőségének a függvénye. A hagyományos HPLC készülékek legfeljebb 400 bar, míg a korszerűbbek akár 1200-1500 bar nyomásesés mellett is üzemeltethetők.
A kromatográfiás módszerek kidolgozásánál figyelembe kell venni az elválasztandó komponensek anyagi minőségét, amely jelentősen meghatározza, hogy milyen kémiai tulajdonságú álló- és mozgófázist válasszunk az elválasztások során.
A nagyhatékonyságú folyadékkromatográfiás módszereket csoportosíthatjuk az álló- és mozgófázis anyagi minősége alapján (1. táblázat):
7.2. táblázat - HPLC módszerek álló- és mozgófázis szerinti osztályozása
Kromatográfiás módszer | Állófázis minősége | Mozgófázis minősége |
|---|---|---|
Normál fázisú kromatográfia (NP-HPLC) | poláris töltet | apoláris |
Fordított fázisú kromatográfia (RP-HPLC) | apoláris töltet | poláris |
Ionkromatográfia (IC) Ionpár kromatográfia (MPIC) Ioncserés kromatográfia (HPIC) Ion kizárásos kromatográfia (HPICE) | apoláris töltet töltéssel rendelkező töltet kationcserélő töltet | poláris oldószer + ionpárképző puffer oldat puffer oldat |
Méretkizárásos kromatográfia (SEC) | nagy pórusátmérővel rendelkező töltet (gél) | víz vagy szerves oldószer |
Hidrofób kölcsönhatáson alapuló kromatográfia (HIC) | hidrofób felületű töltet | sótartalmú oldat, elválasztás során csökkenő só koncentráció |
Normál fázisú folyadékkromatográfia (Normal Phase Liquid Chromatography: NP-HPLC): A normál fázisú folyadékkromatográfiás elválasztásnál az állófázis minden esetben polárisabb, mint a mozgófázis.
NP-HPLC-ben alkalmazott állófázisok: állófázisnak csak azok az adszorbensek felelnek meg, amelyek poláris felülettel és nagy mechanikai stabilitással rendelkeznek:
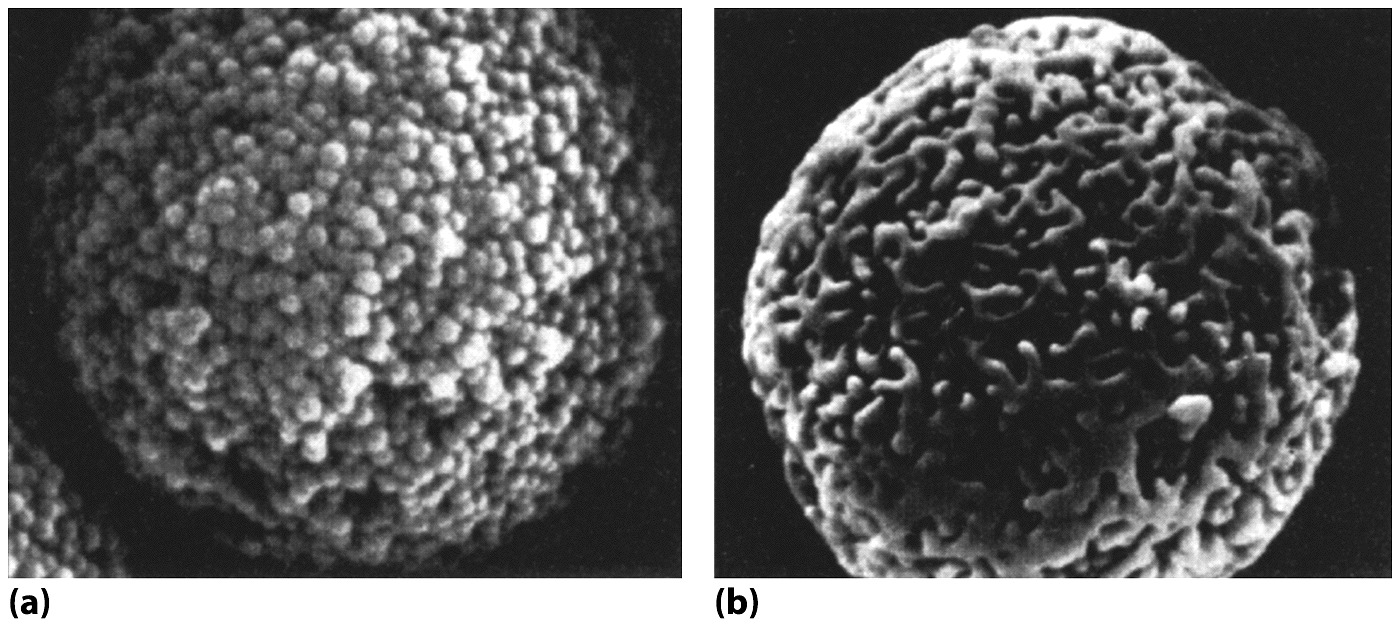
szilikagél (7.5. ábra),
alumínium-oxid,
módosított szilikagél (szilikagél felülete -NH2, -NO2 -CN, csoporttal van módosítva).
NP-HPLC-ben alkalmazott mozgófázisok: a mozgófázisnak azok az apoláris tulajdonságú oldószerek felelnek meg, amelyek kis viszkozitással, jó UV áteresztő képességgel és kis forrásponttal rendelkeznek:
szénhidrogének (hexán, heptán, izooktán)
klórozott szénhidrogének (diklór-metán, triklór-metán, szénteraklorid)
éterek (dietil-, metil-tercbutil-éter, dioxán, tetrahidrofurán)
észterek (metil-acetát, etil-acetát)
alkoholok (metil-, etil-alkohol, izopropil-alkohol)
savak (hangya-, ecetsav)
aminok (dietil-, trietil-, butil-amin)
A normál fázisú kromatográfiában alkalmazott mozgófázisok (eluensek) többsége szénhidrogénekből tevődik össze, amihez kis térfogatrészben (0,1-25 v/v%) poláris oldószert adunk a megfelelő elválasztás érdekében.
Fordított fázisú folyadékkromatográfia (Reversed Phase Liquid Chromatography: RP-HPLC): fordított fázisú kromatográfiás elválasztásról akkor beszélünk, ha az állófázis polaritását tekintve apolárisabb, mint az alkalmazott mozgófázis.
RP-HPLC-ben alkalmazott állófázisok: az állófázis apoláris tulajdonsága mellett követelmény, hogy nagy legyen a mechanikai stabilitása:
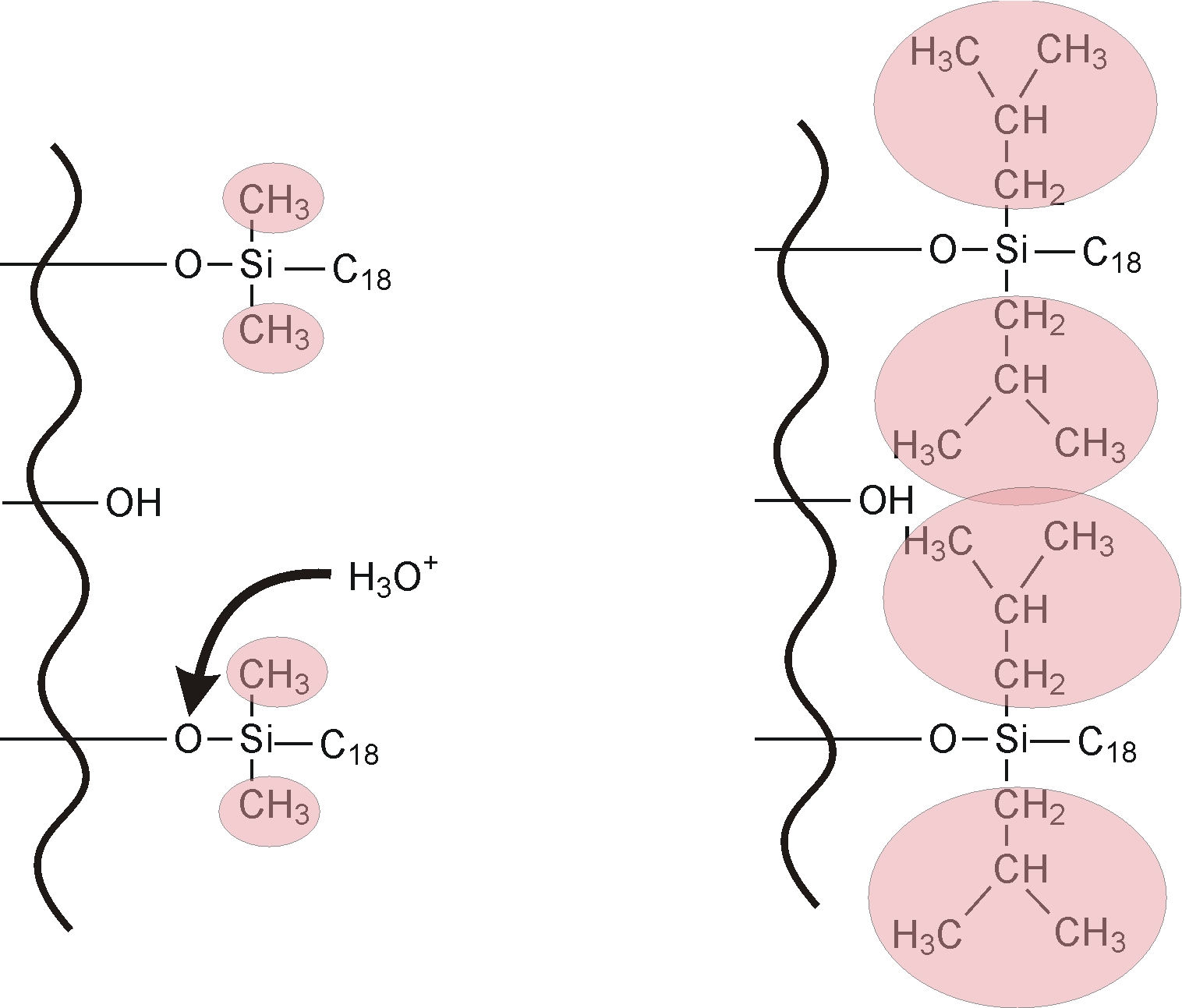
módosított szilikagél (szilikagél felülete –C6, -C8, -C18, -fenil, csoporttal módosítva),
polimerrel bevont szilikagél,
szerves polimer alapú töltetek (sztirol-divinil-benzol alapú),
nyomást álló szén alapú állófázis,
alumínium-oxid alapú állófázis,
cirkónium-oxid alapú állófázis.
Napjainkban a szilikagél alapú állófázisok a legelterjedtebbek az RP-HPLC elválasztásoknál. A szilikagél alapú töltetek előállítása során a szilikagélt alkilcsoportokat tartalmazó klórszilánnal reagáltatják és így tudják módosítani a poláris fázist (7.6. ábra) apolárissá. A módosítás során a szilikagél felületén lévő szilanolcsoportok egy része a sztérikus gátlás miatt nem lép reakcióba a klórszilánnal. Ezeket a csoportokat rövidebb láncú klórszilán vegyületekkel reagáltatják (utánszilanizálás, end capping), amelynek hatására a szabadon lévő szilanolcsoportok egy része már reakcióba tud lépni.
RP-HPLC-ben alkalmazott mozgófázisok: az alkalmazott mozgófázis poláris tulajdonságú, kis viszkozitású és jó UV áteresztő képességű legyen.
Az RP-HPLC vizsgálatok fő eluens komponense a víz, amely az elválasztandó komponensek erős visszatartását eredményezi (elúciós erőssége kicsi), ezért az eluens készítés során a vízzel elegyedő, de nagyobb elúciós képességgel rendelkező szerves oldószert is adunk. A leggyakrabban használt szerves oldószerek: metanol, etanol, izopropil-alkohol, dioxán, tetrahidrofurán.
A szilikagél állóázisok alkalmazásakor nagyon fontos, hogy a mozgófázis kémhatására odafigyeljünk, mivel a szilikagél savas karakterű (polisav) és lúgos közegben oldódik. A mozgófázis kémhatása nem lehet nagyobb (pH=8-9), mint a szilikagél oldhatóságának megfelelő pH érték. A korszerű állófázisok között kaphatók már olyan felületi tulajdonsággal rendelkező töltetek, amelyek használatakor a mozgófázis kémhatása pH=10 értéket is elérheti a szilikagél oldódása nélkül. A kis pH értékű eluensek (pH<1-2) a felületen lévő alkilcsoportok hidrolízisét eredményezheti. A hidrolízist követően megváltozik az állófázis polaritása, amely az elválasztás mechanizmusát jelentősen befolyásolja.
Abban az esetben, ha a megfelelő elválasztás érdekében alkalmazott mozgófázis pH tartománya kívül esik a szilikagél alapú állófázisok működési pH tartományából (pH>8-9 vagy pH<1-2), akkor szerves polimer alapú állófázisokat használunk.
Ionkromatográfia (Ion Chromatography: IC): Az ionkromatográfiás eljárások közé több eltérő mechanizmusú módszer tartozik, amelyekkel ionos vagy ionizálható vegyület elválasztását tudjuk megvalósítani.
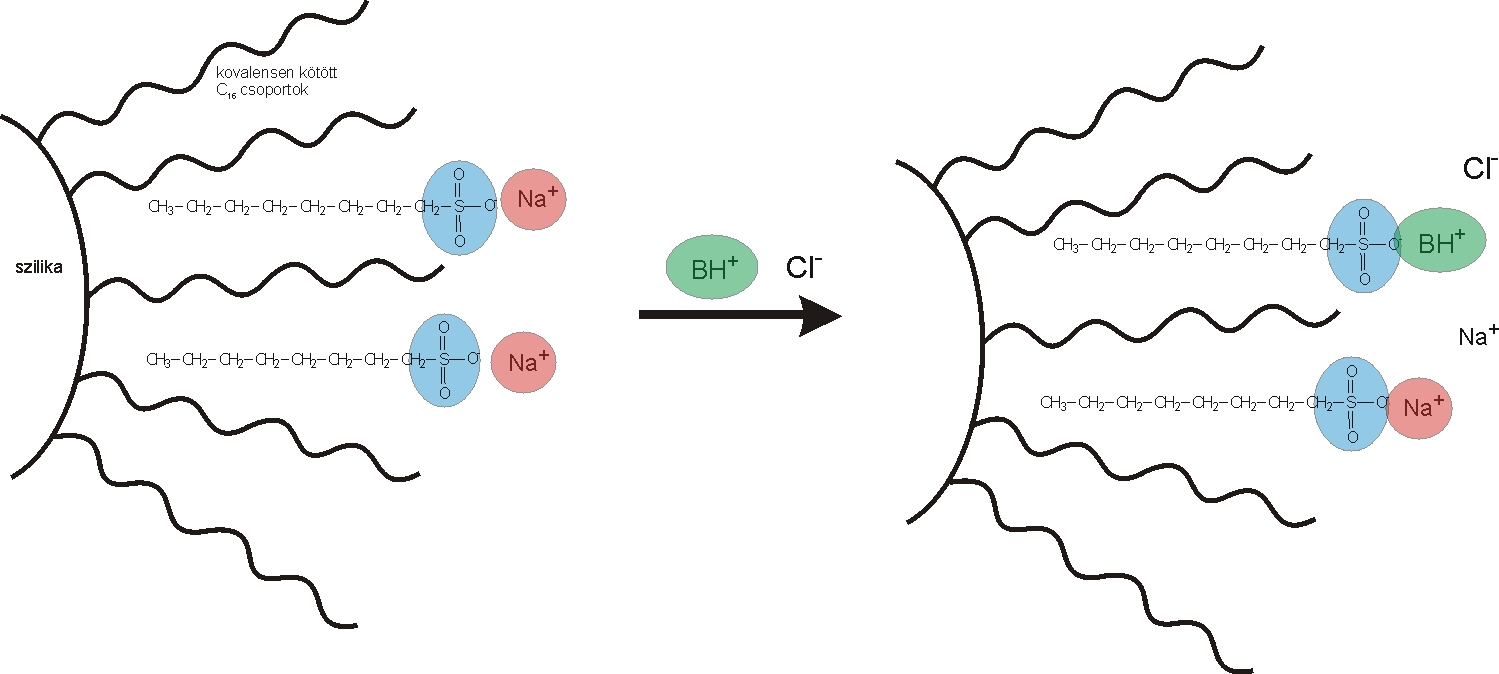
Ionpár kromatográfia (Mobile Phase Ion Chromatography: MPIC): az elválasztás mechanizmusa adszorpción alapul. Az oszlop szelektivitása nagymértékben függ a mozgófázis összetételétől, amely(ek) ionpárképző vegyületet tartalmaz(nak). Az ionpárképző anyagok az elválasztandó ionokkal ionpárokat képeznek, amely hatására megváltoznak a retenciós tulajdonságuk. Az elválasztásokhoz fordított fázisú állófázisokat (7.7. ábra) használunk (módosított szilikagél: szilikagél felülete -C8,-C18, csoporttal módosítva, szerves polimer alapú töltetek: sztirol-divinil-benzol alapú). Ionpár kromatográfiás elválasztások főként felületaktív anionok és kationok, átmenetifém-komplex elválasztására alkalmas.
Ioncserés folyadékkromatográfia (High Performance Ion Exchange Chromatography: HPIC): ioncserés kromatográfiás elválasztásról akkor beszélünk, ha az állófázis felülete töltéssel rendelkezik és ez a töltés állandó, nem változik az analíziskor.
Ioncserés kromatográfiában alkalmazott állófázisok: az ioncserélő állófázisokat töltésük szerint csoportosíthatjuk. Az ioncserélők váza szerves polimer vegyület (sztirol-divinil-benzol), vagy módosított szilikagél.
Kationcserélők esetében a töltet felülete negatív, míg az anioncserélők esetében a töltet felülete pozitív töltésű ionokat tartalmaz.
Azok az ioncserés állófázisok, amelyek a pH=1-14 tartományban nem változtatják meg töltésüket erős kation- és anioncserélők (szulfonsav csoportot-, kvaterner ammóniumiont tartalmazó gyanták). A gyenge anionok, ill. kationok pH változtatására válnak ionos felületűvé (amin-csoport protonálódik, karboxil-csoport disszociál).
Ioncserés kromatográfiában alkalmazott mozgófázisok: az ioncserés kromatográfiában alkalmazott mozgófázisok vizes pufferoldatok és szerves oldószert tartalmazó oldószer elegyek. Az eluensben lévő puffernek kettős szerepe van: a puffer pH-ja a vizsgálandó vegyületek dissszociációfokát, míg a benne lévő só koncentrációja az ellenion mennyiségét tudja befolyásolni. A szerves oldószer mennyiségével a vegyületek oldhatósága befolyásolható.
Ionkizárásos folyadékkromatográfia (High Performance Ion Chromatography Exclusion: HPICE): Az ionkizárásos folyadékkromatográfia elve, hogy nagy kapacitású, erős kationcserélő állófázisokat (teljesen szulfonált sztirol-divinil-benzol) használunk az elválasztásokhoz, amelyek az erős elektrolitokat (pl.: klorid-, jodid-, fluorid ionokat) a szulfonsav taszítása miatt kizárja. Az ionkizárásos kromatográfia gyenge szervetlen és szerves savak, aminosavak, aldehidek és alkoholok elválasztására és meghatározására szolgál.
Méretkizárásos kromatográfia (Size Exclusion Chromatography: SEC): Gélkromatográfiás eljárás vagy gélszűrés. Az elválasztás mechanizmusa a molekulaméret szerinti elválasztáson alapul. Az adott pórusátmérővel rendelkező állófázis (gél) pórusaiba csak meghatározott méretű molekulák férnek be, az átjárható pórustérfogat függ a molekulák méretétől. Azok a molekulák, amelyek a pórus méreténél nagyobbak nem férnek be a pórusokba és kizáródnak.
Hidrofób kölcsönhatású kromatográfia (Hydrophobic Interaction Chromatography: HIC): hidrofób kölcsönhatású kromatográfiával peptideket, polipeptideket tudunk elválasztani. A fehérjék különböző mértékben (aminosav-összetételtől függően) tartalmaznak hidrofób molekularészeket. Nagy sókoncentrációjú mozgófázis alkalmazásakor az apoláris állófázis felületén a fehérjék adszorbeálódnak, majd a sókoncentráció csökkentésével bekövetkezik a fehérjék deszorpciója. A fehérjék ezáltal a polaritásuk különbsége alapján elválaszthatók.
Az eluens tárolására, a mennyiségétől függően különböző térfogatú, általában üvegedényeket használunk.
Az eluensben oldott gázok eltávolítására szolgáló egység. Az oldott gázok a szivattyú ill. szivattyúk folyamatos és egyenletes működését zavarják. Az eluensben oldott gázok komprimálása esetében, a szivattyú nem tudja egyenletesen azonos térfogatban szállítani a mozgófázist.
A nyomás csökkenésével vagy megszűnésével a detektorban buborékok keletkezhetnek. Az eluensekben oldott gázok eltávolítását célszerű először egy ultrahangos fürdőben, néhány percig történő kigázosítással kezdeni, mivel ennek a kezelésnek a hatékonysága sokkal erőteljesebb, mint a készülékekhez tartozó gáztalanító egységeké. Az eluens anyagi minőségétől függően az ultrahang, az oldott gázok mennyiségének kb. 70-85 %-át eltávolítja. Az ultrahangos gáztalanítás során figyelembe kell vennünk, hogy az eluens milyen anyagi minőségű komponens(ek)ből tevődik össze. Illékony vegyületek használatakor nem célszerű az előgáztalanítást hosszú ideig végezni, mert a mozgófázis összetétele megváltozhat.
A szivattyúval szembeni követelmény, hogy pulzálás nélkül, egyenletesen szállítsa a mozgófázist.
Izokratikus elúcióról akkor beszélünk, ha az eluens összetétele az elválasztás ideje alatt állandó, míg gradiens elúció esetén a mozgófázis összetétele időben változik
Kisnyomású keverőegység: a szivattyú előtt helyezkedik el, izokratikus elúciós technika alkalmazása esetén időben a keverés mértéke azonos, gradiens elúciós technika alkalmazása során a keverés mértéke változik. A keverés mértékét a keverő egyes eluensekből történő szívási idejével szabályozzuk.
Nagynyomású keverőegység: a szivattyúk után helyezkedik el, a keverés mértékét a szivattyúk által szállított mennyiséggel szabályozzuk
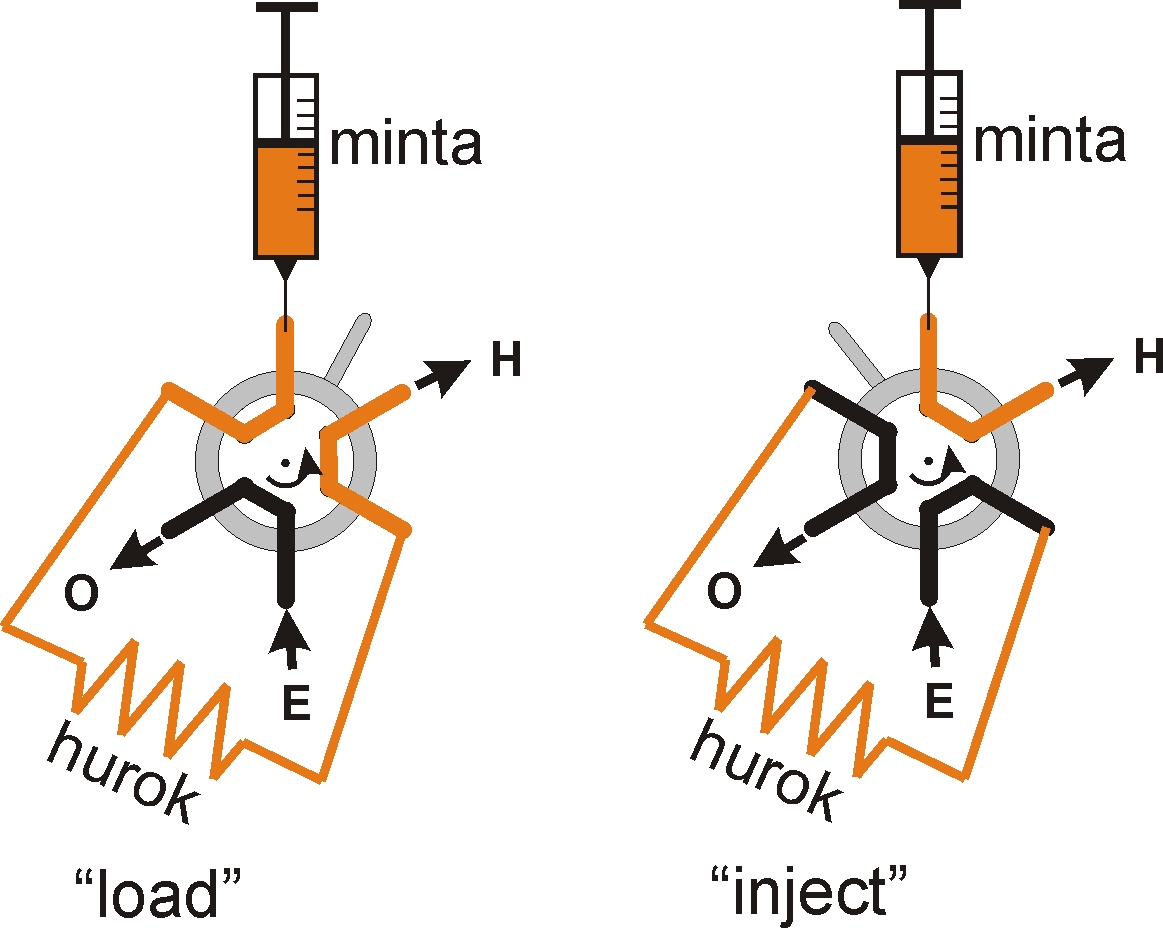
A 7.8. ábra a kétállású, manuális injektor működését mutatja be.
Amikor az injektor „load” állásban van, akkor a mintaadagolására szolgáló fecskendővel a mintaadagoló rendszerhez tartozó, meghatározott térfogatú mintahurkot (loop) tudjuk feltölteni. A felesleges minta egy túlfolyón keresztül távozik a mintahurokból. A minta injektálása akkor következik be, amikor az injektort a „load” pozícióból az „inject” állásba fordítjuk. Ebben az esetben, a mintahurokban lévő többkomponensű elegy az eluens folyamatos áramlásával rámosódik az állófázisra.
Napjainkban egyre jobban elterjed az automata mintaadagoló (autosampler) egységgel felszerelt HPLC készülékek használata. Az ilyen egységgel felszerelt HPLC rendszerek - a mintatartó kivitelezésétől függően - lehetővé tették, hogy a készülékek akár 50-100 vagy ennél is több vizsgálati mintát folyamatosan, egymást követően, egy előre beprogramozott mintatáblázat alapján (pl.: honnan, hányszor, mekkora térfogatot) injektáljanak az állófázisra. Számos készülékben lehetőségünk van a mintatartó tér termosztálására. Ezáltal megoldódott a már szobahőmérsékleten bomló mintaoldatok folyamatos elemzésének a problémája, mivel nem kell az analitikusnak minden egyes injektálást külön elvégeznie, majd az oldat hűtőben való tárolását biztosítania. Az automata mintaadagolók alkalmazása lehetővé teszik a készülékek akár napi 24 órás folyamatos működését is.
A nagyhatékonyságú folyadékkromatográfiás állófázisok technikai kivitelezése (7.9. ábra) függ az elválasztások technikai megvalósításától (analitikai, félpreparatív, preparatív), valamint az alkalmazott kromatográfiás módszertől.
Egy korszerű HPLC készülék tartozékai között szerepel az oszloptermosztát egység is. A reprodukálható elválasztás (az elválasztott komponensek állandó retenciós idővel rendelkezzenek) feltétele, az azonos hőmérsékleten való analízis, amely az állófázis termosztálásával valósítható meg.
Az analízis hőmérsékletének növelése, számos esetben az analízis időigényének csökkenését (retenció csökkenés) és a szelektivitás mértékének javulását eredményezi.
Az elválasztandó vegyületek anyagi minősége és mennyisége jelentősen meghatározza, hogy milyen detektálási módszer kell alkalmazni. A detektorokban használt átfolyós küvetta térfogata 1-10 μl között változik.
Leggyakrabban alkalmazott detektor típusok:
UV, UV-Vis, abszorpciós detektorok,
elektrokémiai detektorok (amperometriás, coulometriás),
vezetőképességi detektorok,
törésmutató különbség mérésén alapuló detektorok,
fényszórás mérésen alapuló detektorok,
radiokémiai detektorok,
tömegspektrométerek,
Fourier transzformációs infravörös spektrométerek.
A nagyhatékonyságú folyadékkromatográfiás laboratóriumi gyakorlat során a hallgató betekintést kap a HPLC készülék felhasználó szintű használatába, egy gyógyszeranalitikai vizsgálati módszer alkalmazásába és az alapvető kromatográfiás összefüggések gyakorlatban történő meghatározására és értelmezésére.
A gyakorlat során a hallgató modulokból összeállított analitikai HPLC készülékkel, a készüléket vezérlő és mérési eredményeket kiértékelő szoftverrel ismerkedik meg, valamint oktató irányításával elvégzi a laboratóriumi gyakorlatra kiadott feladatot.
HPLC készülék felépítése:
Eluenstartó edények: folyadéküvegek
Eluens gáztalanító egység: Degasser: DGU-14A VP (Shimadzu, Japán)
Szivattyúk: Pumps: LC-10AD VP (Shimadzu, Japán)
Manuális mintaadagoló: Injector: 7125 Rheodyne injector (Rheodyne, USA)
Kromatográfiás oszlop: Waters Symmetry C18; (4,6 mm×150 mm; 5 µm; 110 Ǻ) (Waters, USA)
Diódasoros detektor: Diode Array Detector: SPD-M10A VP (Shimadzu, Japán)
System Controller: SCL-10A VP (Shimadzu, Japán)
LabSolution vezérlő és kiértékelő szoftver (Shimadzu, Japán).
Mozgófázis:
A eluens: 0,1 v/v% TFA vizes oldat B eluens: 0,1 v/v%
TFA metanolos oldat.
Az elválasztási módszerek kidolgozása során izokratikus és gradiens elúciós technika alkalmazása.
Vizsgálati minták:
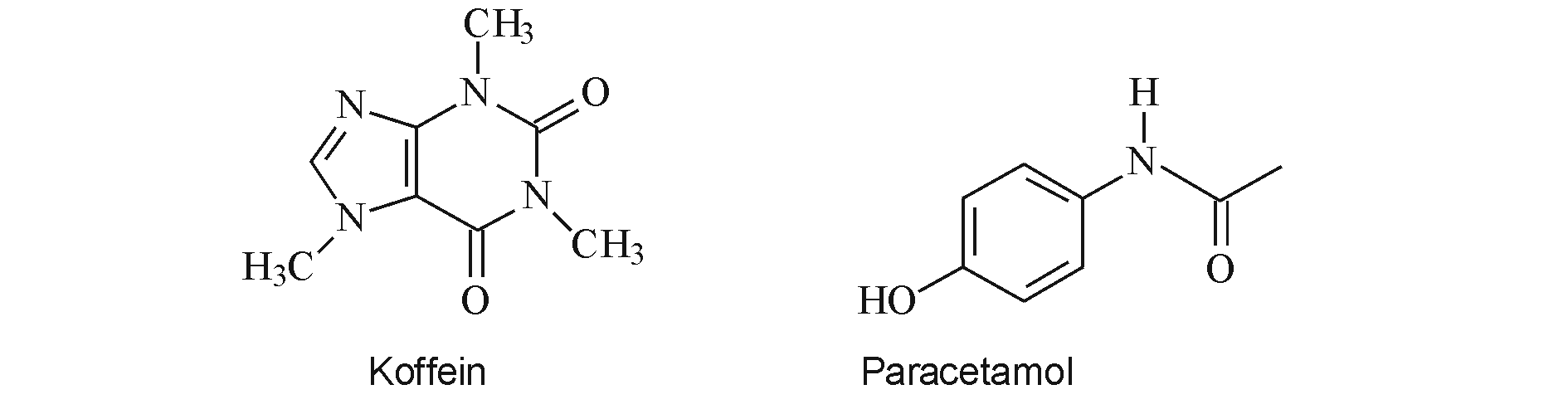
Tiokarbamid: Sigma-Aldrich standard
Paracetamol hatóanyag standard: gyógyszertári hatóanyag standard
Koffein hatóanyag standard: gyógyszertári hatóanyag standard
Saridon tabletta: paracetamol, koffein és propil-fenazonium hatóanyagot tartalmazó orális készítmény.
A gyakorlat során a koffein és a paracetamol hatóanyagot vizsgáljuk.
Tiokarbamid oldat injektálásával határozza meg a kromatográfiás rendszer holtidejét, majd azt vegye figyelembe a kromatográfiás tulajdonságok számításánál
A gyógyszerhatóanyag standard oldatok segítségével adja meg a komponensek retenciós idejét, majd a felvett UV-Vis spektrum alapján határozza meg, a legérzékenyebb mérési hullámhossz értéket, amelynek beállításával együttesen tudja vizsgálni a koffein és a paracetamol vegyületeket.
A gyógyszerhatóanyag oldatok és a Saridon tabletta oldatának injektálásával a kapott kromatogramok alapján végezze el a koffein és paracetamol minőségi azonosítását.
Különböző áramlási sebesség ill. elúciós (izokratikus és gradiens) technikák alkalmazása.
Készítse el a gyógyszerhatóanyagok kalibrációs oldatait (3 pontos kalibráció), majd végezze el a kalibrációs méréseket (3 párhuzamos injektálás), injektálja a Saridon mintaoldatot (3 párhuzamos injektálás) és a kapott kromatogramok alapján készítse el a kalibrációs egyeneseket, valamint számolja ki a Saridon tabletta koffein és paracetamol hatóanyagainak mennyiségét 1 db tablettára vonatkoztatva.
Röviden foglalja össze a HPLC elméletét alkalmazási területek felsorolásával.
Rajzolja fel a gyakorlat során alkalmazott HPLC készülék blokksémáját. Magyarázza el a készülék részeit és határozza meg a funkciójukat.
Kromatogramok értékelése.
A gyakorlati feladatok eredményeinek összefoglalása és értékelése.
Kromatogram, retenció vagy visszatartás, retenciós idő, retenciós térfogat, redukált retenciós idő, redukált retenciós térfogat, holtidő, holttérfogat, megoszlási hányados, szelektivitási tényező, elméleti tányér magasság, elméleti tányérszám, felbontás,
HPLC Nagyhatékonyságú folyadékkromatográfia NP-HPLC
Normál fázisú folyadékkromatográfia RP-HPLC Fordított fázisú
folyadékkromatográfia IC Ionkromatográfia MPIC Ionpár kromatográfia
HPIC Ioncserés folyadékkromatográfia HPICE Ionkizárásos
folyadékkromatográfia SEC Méretkizárásos kromatográfia HIC Hidrofób
kölcsönhatású kromatográfia
Mit nevezünk kromatogramnak?
Egy kromatogramról milyen információkat tud leolvasni?
Egy kromatogram alapján hogy tudunk minőségi azonosítást és mennyiségi kiértékelést végezni?
Mit nevezünk normálfázisú folyadékkromatográfiának?
Milyen az álló- és a mozgófázis egymáshoz viszonyított polaritása a fordított fázisú folyadékkromatográfiában?
Mi a különbség az izokratikus és a gradiens elúciós technika között?
Milyen részekből tevődik össze egy HPLC készülék? Jellemezze az egyes részeit.
Milyen állófázisok ismertek a normál és fordított fázisú folyadékkromatográfiában?
Mit nevezünk utánszilanizálási reakciónak és mi a folyamat célja?
Milyen pH tartományban lehet a szilikagél alapú állófázisokat használni és miért?
Hogyan lehet meghatározni egy kromatográfiás rendszer holtidejét?
Milyen paraméterekből tevődik össze a kromatográfiás rendszer holtideje?
Magyarázza el a kétállású manuális injektor működését!
Elválasztás során mi dönti el, hogy milyen detektor használ a folyamat követésére?
Egy kalibrációs oldatsorozat koncentráció értékeit mi alapján határozza meg?